名校
解题方法
1 . Ⅰ.铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=_______
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为_______
②下列条件能判断该反应达到平衡状态的是_______
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
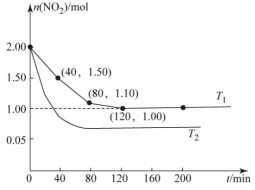
①T1_______ T2(填“>”或“<”)。
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=_______
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_______ 移动(填“正向”“逆向”或“不”)。
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为_______ (室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为
②下列条件能判断该反应达到平衡状态的是
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO
 =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为
您最近一年使用:0次
2021-06-27更新
|
998次组卷
|
8卷引用:四川省广安市2019-2020学年高二下学期期末(零诊)化学试题
四川省广安市2019-2020学年高二下学期期末(零诊)化学试题湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题(已下线)理综化学-2021年秋季高三开学摸底考试卷01(课标全国专用)2021年海南高考化学试题变式题11-19(已下线)备战2022年高考化学精准检测卷【全国卷】08广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题四川省内江市威远中学校2022-2023学年高二下学期第二次阶段性考试理综化学试题
解题方法
2 . 水的分解主要有以下两种途径,途径一是利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物。
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为_______ 。

(2)若将该催化剂置于Na2SO3溶液中,产物之一为 ,另一产物为
,另一产物为_______ 。
途径二是利用硫—碘循环来分解水制氢气,其中主要涉及下列反应:
I SO2+2H2O+I2=H2SO4+2HI
II 2HI⇌H2+I2
III 2H2SO4=2SO2+O2+2H2O
(3)分析上述反应,下列判断正确的是_______ 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生2 mol H2
(4)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如下图所示。0~2 min内的平均反应速率v(HI)=_______ 。该温度下,H2(g)+I2(g)⇌2HI(g)的平衡常数K=_______ 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则平衡时下列物理量不变的是_______ 。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数

(5)用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
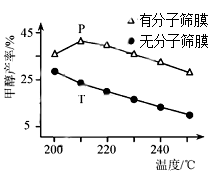
①甲醇平衡产率随温度升高而降低的原因为_______ 。
②P点甲醇产率高于T点的原因为_______ 。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为_______ °C。
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为

(2)若将该催化剂置于Na2SO3溶液中,产物之一为
 ,另一产物为
,另一产物为途径二是利用硫—碘循环来分解水制氢气,其中主要涉及下列反应:
I SO2+2H2O+I2=H2SO4+2HI
II 2HI⇌H2+I2
III 2H2SO4=2SO2+O2+2H2O
(3)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生2 mol H2
(4)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如下图所示。0~2 min内的平均反应速率v(HI)=
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数

(5)用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为
您最近一年使用:0次
解题方法
3 . 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2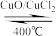 2Cl2+2H2O
2Cl2+2H2O
(1)已知:反应A中,4 mol HCl被氧化,放出116 kJ的热量。

①H2O的结构式是_______ 。
②反应A的热化学方程式是_______ 。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为_______ kJ,HCl中H—Cl键比H2O中H—O键(填“强”或“弱”)_______ 。
(2)对于反应A,下图是4种投料比[n(HCl)∶n(O2)],分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是_______ 。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是:投料比越大,对应的温度_______ 。
③投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______ 。O2转化率为_______ 。
反应A:4HCl+O2
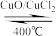 2Cl2+2H2O
2Cl2+2H2O(1)已知:反应A中,4 mol HCl被氧化,放出116 kJ的热量。

①H2O的结构式是
②反应A的热化学方程式是
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为
(2)对于反应A,下图是4种投料比[n(HCl)∶n(O2)],分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是:投料比越大,对应的温度
③投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是
您最近一年使用:0次
4 . 工业上除去电石渣浆 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:

下列说法正确的是
 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:
下列说法正确的是

A. 、 、 在过程Ⅰ、Ⅱ中均起催化剂作用 在过程Ⅰ、Ⅱ中均起催化剂作用 |
B.过程Ⅰ中,反应的离子方程式为 |
C.将10L上清液中的 转化为 转化为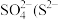 浓度为480 mg·L−1),理论上共需要0.03mol的 浓度为480 mg·L−1),理论上共需要0.03mol的 |
D.常温下,56gCaO溶于水配成1L溶液,溶液中 的数目为 的数目为 个 个 |
您最近一年使用:0次
2021-01-02更新
|
549次组卷
|
5卷引用:安徽省示范高中皖北协作区2020年第22届高三联考理科综合化学
安徽省示范高中皖北协作区2020年第22届高三联考理科综合化学(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)江西省南昌市新建区第二中学2019-2020学年高二下学期期终考试化学试题湖北省龙泉中学、宜昌一中2021届高三下学期2月联合考试化学试题黑龙江省大庆实验中学实验一部2020-2021学年高一下学期开学考试化学试题
名校
解题方法
5 . 作为绿色氧化剂和消毒剂,H2O2在工业生产及日常生活中应用广泛。已知:2H2O2(l)=2H2O(l)+O2(g) △H = -196kJ·mol-1K = 8.29×1040,回答下列问题:
(1)H2O2的电子式为______ ,H2O2能用作消毒剂是因为分子结构中存在______ 键(选填“H-O”或“-O-O-”)。
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的______ (选填编号)。
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。
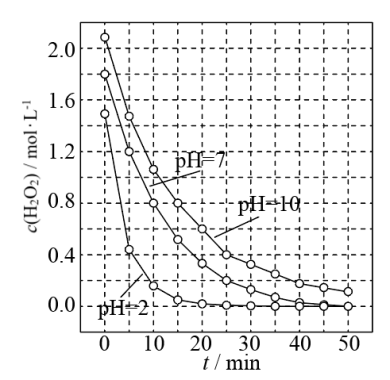
①pH=7时,0~10minH2O2分解反应的平均速率υ=______ mol·L-1·min-1。
②以下对图象的分析正确的是______ (选填序号)。
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因______ 。
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为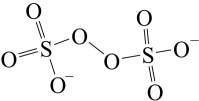 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因_____ 。
(1)H2O2的电子式为
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。

①pH=7时,0~10minH2O2分解反应的平均速率υ=
②以下对图象的分析正确的是
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为
 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
您最近一年使用:0次
2020-12-14更新
|
448次组卷
|
2卷引用:湖北省十一校2021届高三上学期第一次联考化学试题
名校
解题方法
6 . 研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法的不正确的是
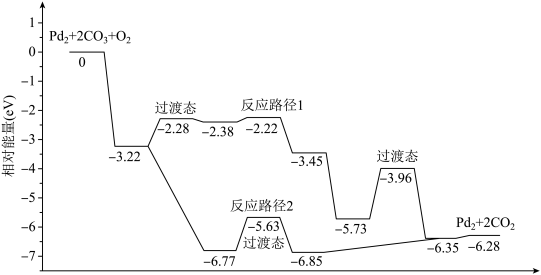

| A.该过程中有极性键和非极性键的断裂和生成 |
| B.反应路径2的催化效果更好 |
| C.催化剂不会改变整个反应的ΔH |
| D.路径1中最大能垒(活化能)E正=1.23eV |
您最近一年使用:0次
2020-12-08更新
|
1108次组卷
|
7卷引用:湖北省武汉市东西湖区华中师范大学第一附属中学2021届高三上学期期中考试化学试题
名校
解题方法
7 . 十九大报告提出“要像对待生命一样对待生态环境”,对氮元素形成的有毒有害气体进行处理成为科学研究的热点。
Ⅰ.我国学者研究了均相 NO-CO 的反应历程:2NO(g)⇌N2(g)+2CO2(g) ΔH<0,模拟结果如图。反应路径中每一阶段内各驻点的能量均为相对于此阶段内反应物能量的能量之差, TS(Transition State)代表过渡态,反应过程中的复杂中间产物直接用 IM(Intermediate Material)表示。回答下列问题:

(1)该反应的ΔH=_______ 。
(2)关于该反应,下列说法正确的是_______ 。
a.均相 NO-CO 反应经历了三个过渡态和五个中间产物
b.整个反应分为三个基元反应阶段,总反应速率由第三阶段反应决定
c.NO 二聚体 )比 N2O 分子更容易与 CO 发生反应
)比 N2O 分子更容易与 CO 发生反应
(3)在恒容密闭容器中通入等物质的量的 CO 和 NO,在一定条件下发生上述反应,为探究速率与浓度的关系,根据相关实验数据,绘制了 2 条速率—浓度关系曲线:v 正~c(NO)和 v 逆~c(CO2),则:与曲线 v 正~c(NO)相对应的是图中曲线_______ (填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,v 正和 v 逆相应的平衡点分别为_______ (填字母)。

(4)在一定温度下向容积为 2L 的密闭容器中加入 0.5 mol NO、0.5 mol CO,此时容器总压为 1×105 Pa, 发生上述反应,4 min 时达平衡,此时测得氮气的物质的量为 0.2 mol,则 0~4min 内用 CO2表示的的平均速率为_______ mol·L-1·min-1,该反应的 Kθ为_______ ,标准平衡常数Kθ= ,其中 pθ为标准压强(1×105Pa),p(N2)、p(CO2)、p(CO)和 p(NO)为各组分的平衡分压[已知 p(NO)=x(NO)·p,其中 p 为平衡总压,x(NO)为平衡系统中 NO 的物质的量分数]。
,其中 pθ为标准压强(1×105Pa),p(N2)、p(CO2)、p(CO)和 p(NO)为各组分的平衡分压[已知 p(NO)=x(NO)·p,其中 p 为平衡总压,x(NO)为平衡系统中 NO 的物质的量分数]。
II.有学者探究以氨气为原料、用电解法制备联氨(N2H4)的效率,装置如图。

(5)写出其阳极电极反应式_______ 。
Ⅰ.我国学者研究了均相 NO-CO 的反应历程:2NO(g)⇌N2(g)+2CO2(g) ΔH<0,模拟结果如图。反应路径中每一阶段内各驻点的能量均为相对于此阶段内反应物能量的能量之差, TS(Transition State)代表过渡态,反应过程中的复杂中间产物直接用 IM(Intermediate Material)表示。回答下列问题:

(1)该反应的ΔH=
(2)关于该反应,下列说法正确的是
a.均相 NO-CO 反应经历了三个过渡态和五个中间产物
b.整个反应分为三个基元反应阶段,总反应速率由第三阶段反应决定
c.NO 二聚体
 )比 N2O 分子更容易与 CO 发生反应
)比 N2O 分子更容易与 CO 发生反应(3)在恒容密闭容器中通入等物质的量的 CO 和 NO,在一定条件下发生上述反应,为探究速率与浓度的关系,根据相关实验数据,绘制了 2 条速率—浓度关系曲线:v 正~c(NO)和 v 逆~c(CO2),则:与曲线 v 正~c(NO)相对应的是图中曲线

(4)在一定温度下向容积为 2L 的密闭容器中加入 0.5 mol NO、0.5 mol CO,此时容器总压为 1×105 Pa, 发生上述反应,4 min 时达平衡,此时测得氮气的物质的量为 0.2 mol,则 0~4min 内用 CO2表示的的平均速率为
 ,其中 pθ为标准压强(1×105Pa),p(N2)、p(CO2)、p(CO)和 p(NO)为各组分的平衡分压[已知 p(NO)=x(NO)·p,其中 p 为平衡总压,x(NO)为平衡系统中 NO 的物质的量分数]。
,其中 pθ为标准压强(1×105Pa),p(N2)、p(CO2)、p(CO)和 p(NO)为各组分的平衡分压[已知 p(NO)=x(NO)·p,其中 p 为平衡总压,x(NO)为平衡系统中 NO 的物质的量分数]。II.有学者探究以氨气为原料、用电解法制备联氨(N2H4)的效率,装置如图。

(5)写出其阳极电极反应式
您最近一年使用:0次
8 . 氨氮废水中的氮元素多以NH 和NH3·H2O的形式存在,在一定条件下,NH
和NH3·H2O的形式存在,在一定条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
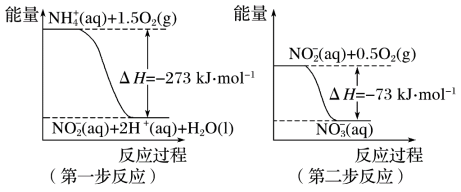
下列说法合理的是
 和NH3·H2O的形式存在,在一定条件下,NH
和NH3·H2O的形式存在,在一定条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下: 
下列说法合理的是
A.该反应的催化剂是NO |
B.升高温度,两步反应速率均加快,有利于NH 转化成NO 转化成NO |
| C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 |
D.1 mol NH 在第一步反应中与1 mol NO 在第一步反应中与1 mol NO 在第二步反应中失电子数之比为1:3 在第二步反应中失电子数之比为1:3 |
您最近一年使用:0次
2020-12-04更新
|
268次组卷
|
2卷引用:湖北省汉川市第二中学2020-2021学年高二上学期期中考试化学试题
解题方法
9 . 纯过氧化氢(H2O2)是淡蓝色的黏稠液体,可任意比例与水混溶,广泛应用于医疗消毒、绿色化学合成等领域。回答下列问题:
(1)已知:H2(g)+ O2(g)=H2O(l)∆H1=-286kJ·mol-1
O2(g)=H2O(l)∆H1=-286kJ·mol-1
H2(g)+O2(g)=H2O2(l)∆H2=-188kJ·mol-1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的∆H=_____ kJ·mol-1。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
①由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是____ 。贮运过氧化氢时,可选用的容器材质为____ (填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
②已知反应:H2O2(l)=H2O(1)+ O2(g)K=2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的
O2(g)K=2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的___ (填编号)。
A.ΔH比较小 B.K不够大 C.速率比较小 D.活化能比较大
(3)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是___ 。
(4)过氧化氢的制备方法很多,早期制备方法如下:
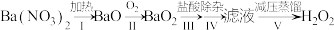
①Ⅰ为分解反应,产物除BaO、O2外,还有一种红棕色气体。该反应的化学方程式是___ 。
②Ⅱ为可逆反应,促进该反应正向进行的措施是___ (答一条即可)。
(1)已知:H2(g)+
 O2(g)=H2O(l)∆H1=-286kJ·mol-1
O2(g)=H2O(l)∆H1=-286kJ·mol-1H2(g)+O2(g)=H2O2(l)∆H2=-188kJ·mol-1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的∆H=
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
| 离子 | 加入量(mg·L-1) | 分解率% | 离子 | 加入量(mg·L-1) | 分解率% |
| 无 | 0 | 2 | Fe3+ | 1.0 | 15 |
| Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
| Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
①由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
②已知反应:H2O2(l)=H2O(1)+
 O2(g)K=2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的
O2(g)K=2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的A.ΔH比较小 B.K不够大 C.速率比较小 D.活化能比较大
(3)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(4)过氧化氢的制备方法很多,早期制备方法如下:
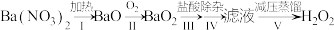
①Ⅰ为分解反应,产物除BaO、O2外,还有一种红棕色气体。该反应的化学方程式是
②Ⅱ为可逆反应,促进该反应正向进行的措施是
您最近一年使用:0次
名校
解题方法
10 . 汽车尾气中含有上百种不同的化合物,其中的污染物有固体悬浮微粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物等。汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应:N2(g) + O2(g) ⇌ 2NO(g),是导致汽车尾气中含有 NO 的原因之一。
(1)已知H2或 CO 可以催化还原 NO 以达到消除污染的目的。
N2(g) + O2(g) = 2NO(g) ΔH = + 180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = - 571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成 N2(g)和H2O(l)的热化学方程式是________ , 判断该反应自发进行的条件:_____ (填“高温自发”或“低温自发”)。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应 2NO(g) + 2CO(g) 2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
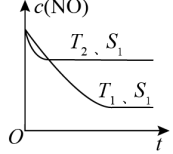
①则该反应 ΔH_____ 0(填“>”或“<”)。
②若催化剂的表面积 S1 > S2,在该图中画出 c(NO)在 T1、S2条件下达到平衡过程中的变化曲线_____________ 。
(3)某研究小组往一恒温恒压容器充入 9 mol N2和 23 mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在 T2、60 MPa 下达到平衡。
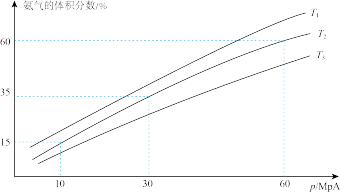
此时N2的平衡分压为_____ MPa。(分压 = 总压 × 物质的量分数)。计算出此时的平衡常数 Kp =_____ (用平衡分压代替平衡浓度计算,结果保留 2 位有效数字)。
(1)已知H2或 CO 可以催化还原 NO 以达到消除污染的目的。
N2(g) + O2(g) = 2NO(g) ΔH = + 180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = - 571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成 N2(g)和H2O(l)的热化学方程式是
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应 2NO(g) + 2CO(g)
 2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①则该反应 ΔH
②若催化剂的表面积 S1 > S2,在该图中画出 c(NO)在 T1、S2条件下达到平衡过程中的变化曲线
(3)某研究小组往一恒温恒压容器充入 9 mol N2和 23 mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在 T2、60 MPa 下达到平衡。

此时N2的平衡分压为
您最近一年使用:0次



