1 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(慢反应)
2I(g)(慢反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(快反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列表述正确的是___________
A.N2O浓度越高其分解速率越快 B.第一步对总反应速率起决定作用
C.第一步活化能比第三步大 D.IO为反应的催化剂
II.1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g) CH2ClCHCICH3(g)ΔH1=-134kJ∙mol-1
CH2ClCHCICH3(g)ΔH1=-134kJ∙mol-1
②CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)ΔH2=-102kJ∙mol-1
CH2=CHCH2Cl(g)+HCl(g)ΔH2=-102kJ∙mol-1
请回答下列问题:
(2)已知CH2=CHCH2C(g)+HCl(g) CH2ClCHClCH(g)的活化能Ea(正)为132kJ∙mol-1,则该反应的活化能Ea(逆)为
CH2ClCHClCH(g)的活化能Ea(正)为132kJ∙mol-1,则该反应的活化能Ea(逆)为__________ kJ∙mol-1。
(3)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①、②,容器内气体的压强随时间的变化如下表所示。
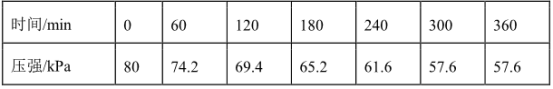
若用单位时间内气体分压的变化来表示反应速率,即v=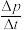 ,则前120min内平均反应速率v(CH2ClCHClCH3)=
,则前120min内平均反应速率v(CH2ClCHClCH3)=________ kPamin-1(保留小数点后2位)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。下列说法错误的是__________ (填代号)。
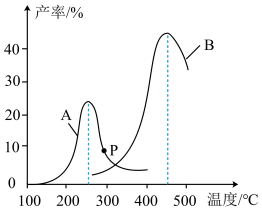
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强会影响CH2ClCHClCH3的产率
c.p点是对应温度下CH2ClCHClCH3的平衡产率
d.提高CH2ClCHClCH3反应选择性的关键因素是控制温度
(5)在四个恒容密闭容器中充入相应量的气体(如图):

发生反应2N2O(g) 2N2(g)+O2(g)ΔH,容器I、II、II中N2O的平衡转化率如图所示:
2N2(g)+O2(g)ΔH,容器I、II、II中N2O的平衡转化率如图所示:
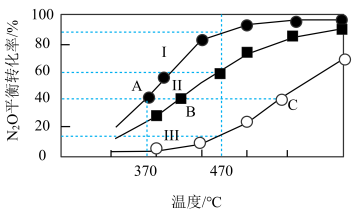
容器I、IV的体积为1L,容器IV中的物质也在470°C下进行反应,起始反应速率:
①v正(N2O)_____ v逆(N2)。(填“>”“<”或“=”)
②图中A、B、C三点处容器内密度最小点是__________ (填“A”“B”或“C”)。
I.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)
 2I(g)(慢反应)
2I(g)(慢反应)第二步I(g)+N2O(g)→N2(g)+IO(g)(快反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列表述正确的是
A.N2O浓度越高其分解速率越快 B.第一步对总反应速率起决定作用
C.第一步活化能比第三步大 D.IO为反应的催化剂
II.1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g)
 CH2ClCHCICH3(g)ΔH1=-134kJ∙mol-1
CH2ClCHCICH3(g)ΔH1=-134kJ∙mol-1②CH2=CHCH3(g)+Cl2(g)
 CH2=CHCH2Cl(g)+HCl(g)ΔH2=-102kJ∙mol-1
CH2=CHCH2Cl(g)+HCl(g)ΔH2=-102kJ∙mol-1请回答下列问题:
(2)已知CH2=CHCH2C(g)+HCl(g)
 CH2ClCHClCH(g)的活化能Ea(正)为132kJ∙mol-1,则该反应的活化能Ea(逆)为
CH2ClCHClCH(g)的活化能Ea(正)为132kJ∙mol-1,则该反应的活化能Ea(逆)为(3)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①、②,容器内气体的压强随时间的变化如下表所示。

若用单位时间内气体分压的变化来表示反应速率,即v=
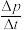 ,则前120min内平均反应速率v(CH2ClCHClCH3)=
,则前120min内平均反应速率v(CH2ClCHClCH3)=(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。下列说法错误的是

a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强会影响CH2ClCHClCH3的产率
c.p点是对应温度下CH2ClCHClCH3的平衡产率
d.提高CH2ClCHClCH3反应选择性的关键因素是控制温度
(5)在四个恒容密闭容器中充入相应量的气体(如图):

发生反应2N2O(g)
 2N2(g)+O2(g)ΔH,容器I、II、II中N2O的平衡转化率如图所示:
2N2(g)+O2(g)ΔH,容器I、II、II中N2O的平衡转化率如图所示:
容器I、IV的体积为1L,容器IV中的物质也在470°C下进行反应,起始反应速率:
①v正(N2O)
②图中A、B、C三点处容器内密度最小点是
您最近一年使用:0次
2 . 碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1平衡常数为K1
FeO(s)+CO(g) ΔH1平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g) FeO(s)+H2(g) ΔH1平衡常数为K2
FeO(s)+H2(g) ΔH1平衡常数为K2
不同温度下,K1、K2的值如下表:
现有反应Ⅲ:H2(g)+CO2(g) CO(g)+H2O(g),结合上表数据,反应Ⅲ是
CO(g)+H2O(g),结合上表数据,反应Ⅲ是___ (填“放热”或“吸热”)反应,为提高CO2的转化率可采用措施有___ (写出任意两条)。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。

①图1中投料比相同,温度从高到低的顺序为______ 。
②图2中m1、m2、m3从大到小的顺序为____ 。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为____ ,T4温度时,该反应平衡常数KP的计算式为____ 。
(3)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
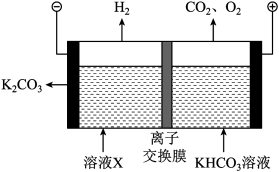
①在阳极区发生的反应包括____ 和H++HCO3- ==CO2↑+H2O
②简述CO32-在阴极区再生的原理:____ 。
(1)反应Ⅰ:Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH1平衡常数为K1
FeO(s)+CO(g) ΔH1平衡常数为K1反应Ⅱ:Fe(s)+H2O(g)
 FeO(s)+H2(g) ΔH1平衡常数为K2
FeO(s)+H2(g) ΔH1平衡常数为K2不同温度下,K1、K2的值如下表:
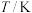 | 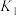 | 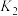 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
现有反应Ⅲ:H2(g)+CO2(g)
 CO(g)+H2O(g),结合上表数据,反应Ⅲ是
CO(g)+H2O(g),结合上表数据,反应Ⅲ是(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
①图1中投料比相同,温度从高到低的顺序为
②图2中m1、m2、m3从大到小的顺序为
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为
(3)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:

①在阳极区发生的反应包括
②简述CO32-在阴极区再生的原理:
您最近一年使用:0次
2019-09-11更新
|
415次组卷
|
2卷引用:湖北省武汉市部分学校2020届新高三起点质量监测化学试题
解题方法
3 . 科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。已知:CO(g)+2H2(g) CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)
CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为________ 。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2发生反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
①5min时三个容器中的反应达到化学平衡状态的是容器_______ (填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______ 。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器___________ 。(填序号)
(3)CO用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lg 与温度(T)的关系如图所示。下列说法正确的是
与温度(T)的关系如图所示。下列说法正确的是_____ (填字母)。
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
请写出加入(通入)a物质一极的电极反应式_________ ;每消耗6.4g甲醇转移的电子数为____ 。
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________ 。
 CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)
CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。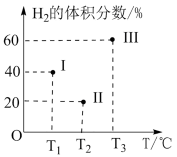
①5min时三个容器中的反应达到化学平衡状态的是容器
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器
(3)CO用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lg
 与温度(T)的关系如图所示。下列说法正确的是
与温度(T)的关系如图所示。下列说法正确的是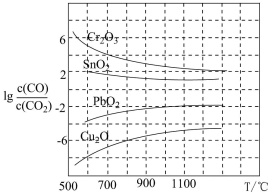
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)a物质一极的电极反应式
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为
您最近一年使用:0次
2019-06-01更新
|
446次组卷
|
2卷引用:湖北部分重点中学2020届高三新起点联考考试化学试题
解题方法
4 . (1)纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II. 将SiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV. TiO2·xH 2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是________ 。II中所采取的操作名称是_______ 。
②III中反应的化学方程式是____________________________________________ 。
③如IV在实验室完成,应将TiO2·xH2O放在________ (填仪器编号)中加热。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
①废水I若采用CO2处理,离子方程式是________________ 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO )越大,净水效果越好,这是因为
)越大,净水效果越好,这是因为______________ 。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++______ =CH3Hg++H+,我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+ 3×10-7mol,是否达到了排放标准__ (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN—成CO2和N2,若参加反应的C12 与CN-的物质的量之比为5︰2,则该反应的离子方程式为__________ 。
资料卡片 | ||
物质 | 熔点 | 沸点 |
SiCl4 | -70℃ | 57.6℃ |
TiCl4 | -25℃ | 136.5℃ |
II. 将SiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV. TiO2·xH 2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是
②III中反应的化学方程式是
③如IV在实验室完成,应将TiO2·xH2O放在

(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

①废水I若采用CO2处理,离子方程式是
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO
 )越大,净水效果越好,这是因为
)越大,净水效果越好,这是因为③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++
④废水Ⅳ常用C12氧化CN—成CO2和N2,若参加反应的C12 与CN-的物质的量之比为5︰2,则该反应的离子方程式为
您最近一年使用:0次
2019-06-01更新
|
286次组卷
|
2卷引用:湖北部分重点中学2020届高三新起点联考考试化学试题
解题方法
5 . 近年来由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式___________ 。
(2)已知:CO(g) + H2O(g) H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
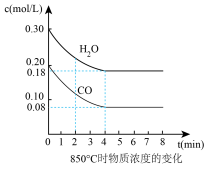
下列说法正确的是___________(填序号)
(3)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,amol CO2和bmol H2.若达平衡时各组分体积分数都与(2)中平衡时相同,则a=___________ mol,b=___________ mol。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
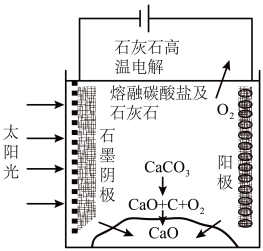
①上述生产过程的能量转化方式是___________ 。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO _4e-=2CO2↑+O2↑,则阴极的电极反应式为
_4e-=2CO2↑+O2↑,则阴极的电极反应式为___________ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
(2)已知:CO(g) + H2O(g)
 H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
下列说法正确的是___________(填序号)
| A.达到平衡时,氢气的物质的量是0.12mol |
| B.达到平衡时,反应体系最终会放出49.44kJ热量 |
| C.4min内CO2的反应速率为0.003 mol/(L·min) |
| D.第8min时,若充入氦气,不会导致v正(CO) < v逆(H2O) |
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO
 _4e-=2CO2↑+O2↑,则阴极的电极反应式为
_4e-=2CO2↑+O2↑,则阴极的电极反应式为
您最近一年使用:0次
2017-08-31更新
|
94次组卷
|
2卷引用:湖北省部分重点中学2018届高三起点考试化学试题



