名校
解题方法
1 . 请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化后气化的方法提纯,其除杂质过程为把杂质用热的重铬酸钾(K2Cr2O7)酸性溶液浸泡发生反应,溶液逐渐变成浅绿色(Cr3+),同时产生使澄清石灰水变浑浊的气体,写出反应的离子方程式:____________________________________________ 。
(2)焦炭可用于制取水煤气。测得24g碳与水蒸气完全反应生成水煤气时,吸收了263.2kJ热量。该反应的热化学方程式为_________________________________ 。
(3)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为CO(g)+2H2(g) CH3OH(g) △H1=-116kJ·mol-1。
CH3OH(g) △H1=-116kJ·mol-1。
①下列措施有利于提高反应物转化率的是___________ (填序号)。
A.及时将CH3OH与反应混合物分离 B.降低反应温度
C.减小体系压强 D.使用高效催化剂
②乙醇电池具有很高的实用价值。如右图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为_________________________________ 。
③已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3=? kJ·mol-1
O2(g)=H2O(g) △H3=? kJ·mol-1
1mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,则△H3=________________ 。
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律,如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答下列问题:

(i)在上述三种温度中,曲线X对应的温度是______________________ 。
(ii)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___________ 。
(4)CO2经常用氢氧化钠溶液来吸收,现有0.2moCO2,若用100mL3 mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为______________________ 。
(1)我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化后气化的方法提纯,其除杂质过程为把杂质用热的重铬酸钾(K2Cr2O7)酸性溶液浸泡发生反应,溶液逐渐变成浅绿色(Cr3+),同时产生使澄清石灰水变浑浊的气体,写出反应的离子方程式:
(2)焦炭可用于制取水煤气。测得24g碳与水蒸气完全反应生成水煤气时,吸收了263.2kJ热量。该反应的热化学方程式为
(3)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为CO(g)+2H2(g)
 CH3OH(g) △H1=-116kJ·mol-1。
CH3OH(g) △H1=-116kJ·mol-1。①下列措施有利于提高反应物转化率的是
A.及时将CH3OH与反应混合物分离 B.降低反应温度
C.减小体系压强 D.使用高效催化剂
②乙醇电池具有很高的实用价值。如右图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为

③已知:CO(g)+
 O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1H2(g)+
 O2(g)=H2O(g) △H3=? kJ·mol-1
O2(g)=H2O(g) △H3=? kJ·mol-11mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,则△H3=
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律,如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答下列问题:

(i)在上述三种温度中,曲线X对应的温度是
(ii)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)CO2经常用氢氧化钠溶液来吸收,现有0.2moCO2,若用100mL3 mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
真题
名校
2 . 明矾石经处理后得到明矾【 KAl(SO4)2·12H2O】。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
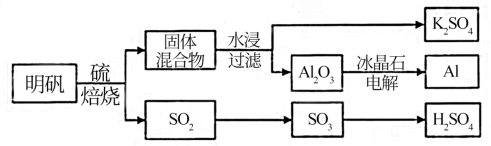
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________ 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________ 。
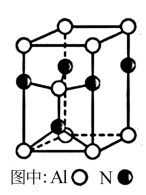
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____ 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________ 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________ 。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________ t。

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是
(2)从水浸后的滤液中得到K2SO4晶体的方法是

(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)
 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸
您最近一年使用:0次
2019-01-30更新
|
1179次组卷
|
10卷引用:贵州省余庆中学2019-2020学年上学期开学考试高三化学试题
贵州省余庆中学2019-2020学年上学期开学考试高三化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(四川卷)(已下线)2014届高考化学二轮复习必做训练 化工生产流程、无机物的判断练习卷(已下线)2014届吉林省延边州高三上学期质量检测理综化学试卷(已下线)2013-2014北京101中学高三第三次月考理综化学试卷(已下线)2014届江西省金溪一中高三理科综合训练题(一)化学试卷2015届山东省济宁市金乡县第二中学高三4月质量检测化学试卷(已下线)2014届北京101中学高三年级第三次月考理综化学试卷2020届高三化学二轮选修大题必练 — —— 以“化工流程”为载体的综合实验三轮冲刺2020届高三化学考题必刷——无机化合物制备的定量、定性分析题
名校
3 . 化学与生活生产密切相关。下列说法中,不正确 的是
| A.将海水直接电解可获得 Mg及Cl2等单质 |
| B.把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵 |
| C.施用适量石膏可降低盐碱地(含较多NaCl、Na2CO3)的碱性 |
| D.施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用 |
您最近一年使用:0次
2018-01-27更新
|
3683次组卷
|
4卷引用:【全国百强校】贵州省铜仁市第一中学2018-2019学年高二下学期开学考试化学试题
解题方法
4 . 氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
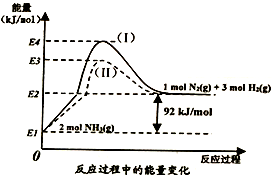
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为__________________________ 。
②过程(I)和过程(Ⅱ)的反应热__________ (填“相同”或“不同”),原因是_______________ 。
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g) 2NH3(g)的平衡常数为
2NH3(g)的平衡常数为__________ ,H2的平衡转化率为__________________________ 。
(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol
反应Ⅱ:N2(g)+O2(g) 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol
则:反应Ⅱ中的b=______ kJ/mol(用含a、c的代数式表示),反应Ⅲ中的△S________ 0(填“>”“<”或“=”)。
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:
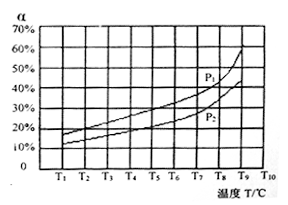
①分析得P1_________ P2 (填“>”“<”或“=”)。
②下列叙述中,不能判断反应Ⅲ已经达到平衡状态的标志是__________ (填序号)。
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:

①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
②过程(I)和过程(Ⅱ)的反应热
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g)
 2NH3(g)的平衡常数为
2NH3(g)的平衡常数为(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol反应Ⅱ:N2(g)+O2(g)
 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol则:反应Ⅱ中的b=
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:

①分析得P1
②下列叙述中,不能判断反应Ⅲ已经达到平衡状态的标志是
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
您最近一年使用:0次
名校
解题方法
5 . 汽车尾气中含有上百种不同的化合物,其中的污染物有固体悬浮颗粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等,一辆轿车一年排放的有害废气比自身重量大3倍。其中NO气体是由于内燃机燃烧的高温引起N2和O2反应所致:N2(g)+O2(g) 2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向4L密闭容器中充入N2和O2各4mol,平衡时,5分钟后O2的物质的量为1mol,则N2的反应速率是____________ 。
(2)恒容条件下,判断该反应达到平衡的标志是________ 。(填字母序号)。
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
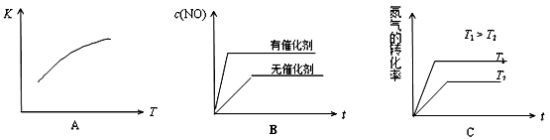
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________ (填字母序号)。
(4)可逆反应N2(g)+O2(g) 2NO(g)的平衡常数表达式为
2NO(g)的平衡常数表达式为____________ 。温度升高,平衡常数将会_____________ (填“增大、或“减小”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应___________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(6)火箭燃料N2H4(肼)在NO2中燃烧,生成N2、液态水。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+67kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
由此请写出发射火箭时燃烧反应的热化学方程式____________________ 。
 2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:(1)某温度下,向4L密闭容器中充入N2和O2各4mol,平衡时,5分钟后O2的物质的量为1mol,则N2的反应速率是
(2)恒容条件下,判断该反应达到平衡的标志是
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是
(4)可逆反应N2(g)+O2(g)
 2NO(g)的平衡常数表达式为
2NO(g)的平衡常数表达式为(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应
(6)火箭燃料N2H4(肼)在NO2中燃烧,生成N2、液态水。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+67kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
由此请写出发射火箭时燃烧反应的热化学方程式
您最近一年使用:0次



