1 . 硒(Se)是第四周期VIA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
(1)T°C时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)⇌H2Se(g)。以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:
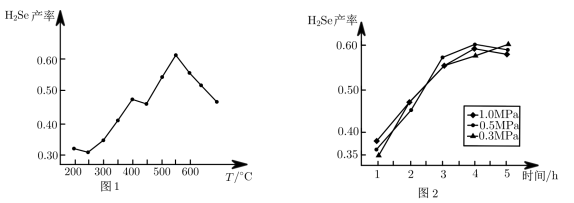
则制备H2Se的最佳温度和压强为_____ 。
(2)由H2Se在一定条件下制备CuSe,已知25℃时CuSe的Ksp=7.9×10-49,CuS的Ksp=l.3×10-36,则反应CuS(s)+Se2-(aq)⇌CuSe(s)+S2-(aq)的化学平衡常数K=____ (保留2位有效数字)。
(1)T°C时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)⇌H2Se(g)。以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:

则制备H2Se的最佳温度和压强为
(2)由H2Se在一定条件下制备CuSe,已知25℃时CuSe的Ksp=7.9×10-49,CuS的Ksp=l.3×10-36,则反应CuS(s)+Se2-(aq)⇌CuSe(s)+S2-(aq)的化学平衡常数K=
您最近一年使用:0次
2 . 二甲醚制备两种方法原理如下
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。
①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。
②CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
③2CH3OH(g) CH3OCH3 (g)+H2O(g) △H3
CH3OCH3 (g)+H2O(g) △H3
(1)若由合成气(CO、H2)直接制备 1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=___________ kJ·mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)下列有关反应①叙述不正确的是___________
a.达到平衡后,升高温度,ν正减少、ν逆增大,平衡逆向移动
b.当四种物质的浓度相等,反应达到化学平衡状态
c.若改变条件,反应物的转化率一定增大,正反应速率一定大于逆反应速率
d.当达到平衡时2v正(O2)=v逆(CH4)
e.向该恒容平衡体系中充入氩气,ν正、ν逆均增大,平衡向右移动
(3)有人模拟制备原理Ⅱ,绘制如图甲图象:
i说明CO的转化率随温度升高先增大后减小的原因:______________________ 。
ii.反应②自发进行的条件是______________________ 。
iii.若在350℃时的2L的密闭容器中充入2 mol CO和6molH2,8min达到平衡,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________ ;可逆反应③的平衡常数K3=___________ 。
iv.若350℃时测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___________ ν(逆),说明原因_________ 。


甲 乙
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图乙所示则b极的电极反应式为___________________________ 。
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。
①2CH4(g)+O2(g)
 CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。
②CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2③2CH3OH(g)
 CH3OCH3 (g)+H2O(g) △H3
CH3OCH3 (g)+H2O(g) △H3(1)若由合成气(CO、H2)直接制备 1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=
(2)下列有关反应①叙述不正确的是
a.达到平衡后,升高温度,ν正减少、ν逆增大,平衡逆向移动
b.当四种物质的浓度相等,反应达到化学平衡状态
c.若改变条件,反应物的转化率一定增大,正反应速率一定大于逆反应速率
d.当达到平衡时2v正(O2)=v逆(CH4)
e.向该恒容平衡体系中充入氩气,ν正、ν逆均增大,平衡向右移动
(3)有人模拟制备原理Ⅱ,绘制如图甲图象:
i说明CO的转化率随温度升高先增大后减小的原因:
ii.反应②自发进行的条件是
iii.若在350℃时的2L的密闭容器中充入2 mol CO和6molH2,8min达到平衡,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是
iv.若350℃时测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)


甲 乙
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图乙所示则b极的电极反应式为
您最近一年使用:0次
名校
3 . (1)现用氯化铜晶体(CuCl2·2H2O,含少量FeCl2杂质)制取纯净的CuCl2·2H2O,先将其制成水溶液,后按如图步骤进行提纯:
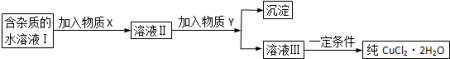
已知:相关物质的溶度积常数见下表:
请回答下列问题:
①请从下列物质中选出第一步中需加入的X( )
a.NaClO b.H2O2 c.KMnO4 d.HNO3
②溶液Ⅱ中含有少量的Fe3+,如何检验该离子的存在:_____________________________ 。
③若此时溶液中的c(Cu2+)=0.02mol/L,为得到纯净的CuCl2·2H2O晶体,可加入CuO固体,使溶液中的Fe3+完全转化为Fe(OH)3沉淀且不沉淀Cu2+,调节pH的范围是_______ 。(通常认为残留在溶液中的离子浓度小于或等于1×10ˉ5 mol/L时就认为沉淀完全)。
④由溶液Ⅲ得到CuCl2·2H2O晶体的操作是___________________________________ 。
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiO(OH)+H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列问题:
①放电时,金属Cd作_______ 极;
②充电时的阳极电极反应式为_____________________________________________ 。
③充电时,当电路中通过0.2moleˉ,阴极质量将_______ (填“增加”、“减少”)___ g。

已知:相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| Ksp | 2.0×10ˉ20 | 1.0×10ˉ38 | 1.64×10ˉ14 |
请回答下列问题:
①请从下列物质中选出第一步中需加入的X
a.NaClO b.H2O2 c.KMnO4 d.HNO3
②溶液Ⅱ中含有少量的Fe3+,如何检验该离子的存在:
③若此时溶液中的c(Cu2+)=0.02mol/L,为得到纯净的CuCl2·2H2O晶体,可加入CuO固体,使溶液中的Fe3+完全转化为Fe(OH)3沉淀且不沉淀Cu2+,调节pH的范围是
④由溶液Ⅲ得到CuCl2·2H2O晶体的操作是
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiO(OH)+H2O
 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2回答下列问题:
①放电时,金属Cd作
②充电时的阳极电极反应式为
③充电时,当电路中通过0.2moleˉ,阴极质量将
您最近一年使用:0次
名校
4 . 工业生产苯乙烯是利用乙苯的脱氢反应:

针对上述反应,在其它条件不变时,下列说法正确的是( )

针对上述反应,在其它条件不变时,下列说法正确的是( )
| A.加入适当催化剂,可以提高苯乙烯的产量 |
| B.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率 |
| C.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件 |
| D.加入乙苯至反应达到平衡过程中,混合气体的平均相对分子质量不断增大 |
您最近一年使用:0次
2018-06-29更新
|
289次组卷
|
6卷引用:贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高二上学期期末考试化学试题
5 . CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______ (写离子符号);若所得溶液c(HCO3−)∶c(CO32−)=2∶1,溶液pH=___________ 。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g)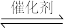 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=_________ 。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______ (填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________ 。
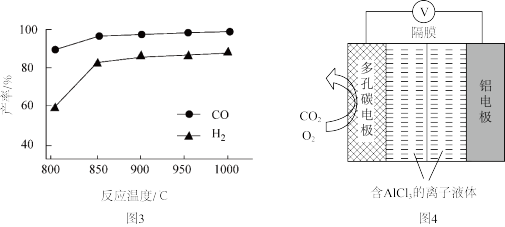
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________ 。
电池的正极反应式:6O2+6e− 6O2−
6O2−
6CO2+6O2− 3C2O42−+6O2
3C2O42−+6O2
反应过程中O2的作用是________ 。
该电池的总反应式:________ 。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g)
 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是

(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:
电池的正极反应式:6O2+6e−
 6O2−
6O2−6CO2+6O2−
 3C2O42−+6O2
3C2O42−+6O2反应过程中O2的作用是
该电池的总反应式:
您最近一年使用:0次
2018-06-09更新
|
4894次组卷
|
11卷引用:贵州省惠水县第一高级中学2019-2020学年高三上学期期末考试化学试题
贵州省惠水县第一高级中学2019-2020学年高三上学期期末考试化学试题2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期12月月考化学试题云南省玉溪元江民中2020届高三开学考试化学试题天津市宁河区芦台第一中学2022-2023学年高三上学期1月期末考试化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练四川省蓬安中学校2020届高三上学期入学考试化学试题(已下线)化学(上海A卷)-学易金卷:2023年高考第一次模拟考试卷浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷10-2023新东方高二上期中考化学
名校
6 . 甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
(1)某研究小组,在温度和容器的容积保持不变时,研究该反应是否达到平衡状态,以下五位同学对平衡状态的描述正确的是__________ 。
A.甲:H2的消耗速率等于CH3OH的生成速率
B.乙:容器内的压强保持不变
C.丙:容器内气体的密度保持不变
D.丁:容器中气体的平均摩尔质量保持不变
(2)若在一定温度下、容积为2L的密闭容器中,投入2 mol CO、4 mol H2,保持恒温、恒容,测得反应达到平衡时H2转化率为75%,求平衡时CH3OH的浓度=__________ mol/L
(3)已知在298K、101kPa下:甲醇的燃烧热化学方程式为:
CH3OH(l)+ 3/2 O2(g)= CO2(g)+ 2H2O(l) ΔH= -725.8 kJ·mol-1;
CO的燃烧热化学方程式为:CO(g)+ 1/2 O2(g)= CO2(g) ΔH= -283 kJ·mol-1;
H2O (g) === H2O(l) ΔH= -44 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式__________ 。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)
①该电池中通入甲醇的是电源的__________ (填正、负)极,若KOH溶液足量,则写出电池总反应的离子方程式__________ 。
②若电解质溶液中KOH的物质的量为0.5mol,当有0.5mol甲醇参与反应时,产物恰好为KHCO3时,该电池的负极反应式为__________ ,所得溶液中各种离子的物质的量浓度由大到小的顺序是__________ 。
 CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1(1)某研究小组,在温度和容器的容积保持不变时,研究该反应是否达到平衡状态,以下五位同学对平衡状态的描述正确的是
A.甲:H2的消耗速率等于CH3OH的生成速率
B.乙:容器内的压强保持不变
C.丙:容器内气体的密度保持不变
D.丁:容器中气体的平均摩尔质量保持不变
(2)若在一定温度下、容积为2L的密闭容器中,投入2 mol CO、4 mol H2,保持恒温、恒容,测得反应达到平衡时H2转化率为75%,求平衡时CH3OH的浓度=
(3)已知在298K、101kPa下:甲醇的燃烧热化学方程式为:
CH3OH(l)+ 3/2 O2(g)= CO2(g)+ 2H2O(l) ΔH= -725.8 kJ·mol-1;
CO的燃烧热化学方程式为:CO(g)+ 1/2 O2(g)= CO2(g) ΔH= -283 kJ·mol-1;
H2O (g) === H2O(l) ΔH= -44 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)
①该电池中通入甲醇的是电源的
②若电解质溶液中KOH的物质的量为0.5mol,当有0.5mol甲醇参与反应时,产物恰好为KHCO3时,该电池的负极反应式为
您最近一年使用:0次
7 . 根据有关知识回答下列问题
(1)25℃时,0.1 mol‧L-1的一元酸HA溶液中c(H+)=1.0×10-4 mol‧L-1,请回答下列问题:此时溶液的pH=_______ ,HA是________ 酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显_____ 性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01 mol‧L-1的三种酸式盐溶液,pH最小是_________ 。
(3)向50ml 0.018mol‧L-1的AgNO3溶液中加入50m1 0.020mol‧L-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=__ mol‧L-1。
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 mol‧L-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_______ 滴定管中.(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是:__________________________________________ 。
③下列操作可能使测量结果偏高的是__________ 。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度______________ 。
(1)25℃时,0.1 mol‧L-1的一元酸HA溶液中c(H+)=1.0×10-4 mol‧L-1,请回答下列问题:此时溶液的pH=
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显
②25℃时,物质的量浓度均为0.01 mol‧L-1的三种酸式盐溶液,pH最小是
(3)向50ml 0.018mol‧L-1的AgNO3溶液中加入50m1 0.020mol‧L-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 mol‧L-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在
②滴定至终点时的实验现象是:
③下列操作可能使测量结果偏高的是
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度
您最近一年使用:0次
8 . 关于下列四个图象的说法中不正确 的是


A.图①可表示可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0 CO2(g)+H2(g) ΔH<0 |
| B.图②表示用惰性电极电解足量氯化钠溶液时,两极产生的气体物质的量相等 |
C.图③可表示可逆反应:A2(g)+3B2(g) 2AB3(g) ΔH>0 2AB3(g) ΔH>0 |
D.图④可表示压强对可逆反应:2A(g)+B(g) 3C(g)+D(s)的影响,且乙压强大 3C(g)+D(s)的影响,且乙压强大 |
您最近一年使用:0次
名校
9 . 判断正误
(1)明矾和高铁酸钠(Na2FeO4)都可用于水的消毒净化。___
(2)硫酸钡和碳酸钡都难溶于水,故都可用于钡餐透视。___
(3)液氨是纯净物,氨常用作制冷剂,是因为其沸点较高,很容易液化;氨水呈碱性,是因为氨溶于水生成一水合氨电离产生OH-,使溶液中c(OH-)>c(H+),故溶液呈碱性,同时也抑制了水的电离。___
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”; 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”;SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾。____
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。____
(6)通电时,溶液中溶质离子分别向两极移动,胶体中胶粒向某一极移动。____
(7)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性。_____
(8)同主族元素的简单阴离子还原性越强,水解程度越大。___
(9)已知次磷酸(H3PO2)是一元弱(中强)酸,且Ka(H3PO2)>Kb(NH3.H2O)。则NH4H2PO2是正盐,且其水溶液呈酸性。____
(10)Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝;工业上也常用电解钠、镁的氧化物来制备相应的金属单质。____
(1)明矾和高铁酸钠(Na2FeO4)都可用于水的消毒净化。
(2)硫酸钡和碳酸钡都难溶于水,故都可用于钡餐透视。
(3)液氨是纯净物,氨常用作制冷剂,是因为其沸点较高,很容易液化;氨水呈碱性,是因为氨溶于水生成一水合氨电离产生OH-,使溶液中c(OH-)>c(H+),故溶液呈碱性,同时也抑制了水的电离。
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”; 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”;SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾。
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。
(6)通电时,溶液中溶质离子分别向两极移动,胶体中胶粒向某一极移动。
(7)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性。
(8)同主族元素的简单阴离子还原性越强,水解程度越大。
(9)已知次磷酸(H3PO2)是一元弱(中强)酸,且Ka(H3PO2)>Kb(NH3.H2O)。则NH4H2PO2是正盐,且其水溶液呈酸性。
(10)Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝;工业上也常用电解钠、镁的氧化物来制备相应的金属单质。
您最近一年使用:0次
2018-01-21更新
|
90次组卷
|
2卷引用:贵州省思南中学2017-2018学年高二上学期期末考试化学试题
名校
解题方法
10 . 硫的氧化物、氮的氧化物是严重的大气污染物,可以通过以下方法处理:
催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
(l)已知:N2(g)+O2(g) 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
则反应:2N0(g)+2CO(g) N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=________ kJ/mol。
(2)氮氧化物和碳氧化物在催化剂作用下可发生反应:2C0+2NO(g) N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=
N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=______ 。

(3)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率v逆(CO2)_____ B点的正反应速率为v正(CO2)(填“>”、“<”或 “=”)。
(4)SO2可用氢氧化钠来吸收。现有0.4molSO2,若用200mL 3mol·L-1NaOH溶液将其完全吸收,生成物为_____ (填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为________ 。
(5)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:_________ 。
(6)已知常温下Fe(OH)3的Ksp=4.0×10-38。若某氢氧化镁溶液的PH=9,则该溶液中c(Fe3+)最大为_________ 。
催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:
2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g)(l)已知:N2(g)+O2(g)
 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol| 化学键 | O=O | C=O | C≡O | N≡N |
| 键能(kJ/mol) |
 N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=(2)氮氧化物和碳氧化物在催化剂作用下可发生反应:2C0+2NO(g)
 N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=
N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=
(3)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。①A点的逆反应速率v逆(CO2)
(4)SO2可用氢氧化钠来吸收。现有0.4molSO2,若用200mL 3mol·L-1NaOH溶液将其完全吸收,生成物为
(5)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:
(6)已知常温下Fe(OH)3的Ksp=4.0×10-38。若某氢氧化镁溶液的PH=9,则该溶液中c(Fe3+)最大为
您最近一年使用:0次



