解题方法
1 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______ (填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2 mol NH3,此时压强为p0,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=_____ 。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压p总×体积分数)
(2)关于合成氨工艺的理解,下列说法不正确的是______ (填标号)。
A合成氨工业常采用的反应温度为500 °C左右,主要是为了节约能源
B使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C合成氨工业采用的压强为10 MPa~30 MPa,是因为常压下N2和H2的转化率不高
(3)在1 L1 mol/L盐酸中缓缓通入2 mol氨气,请在图1中画出溶液中水电离出的OH-浓度随通入氨气的物质的量变化的趋势图_______ 。

(4)电化学法合成氨:图2是用低温固体质子导体作电解质,

用Pt- CN,作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为_______ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:_______ 。
(1)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7. 9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是
②温度为T时,在恒容的密闭容器中加入2 mol NH3,此时压强为p0,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=(2)关于合成氨工艺的理解,下列说法不正确的是
A合成氨工业常采用的反应温度为500 °C左右,主要是为了节约能源
B使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C合成氨工业采用的压强为10 MPa~30 MPa,是因为常压下N2和H2的转化率不高
(3)在1 L1 mol/L盐酸中缓缓通入2 mol氨气,请在图1中画出溶液中水电离出的OH-浓度随通入氨气的物质的量变化的趋势图

(4)电化学法合成氨:图2是用低温固体质子导体作电解质,

用Pt- CN,作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:
您最近一年使用:0次
2 . CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是___ ;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g) CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3
则△H3=___ ,表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___ ;
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)其平衡常数表达式为K=____ 。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___ 。
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据分析:
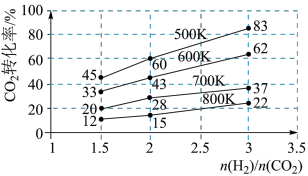
①降低温度,平衡向____ 方向移动。
②在700K、起始投料比 =1.5时,H2的转化率为
=1.5时,H2的转化率为___ 。
③在500K、起始投料比 =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH3CH2OH的浓度为
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH3CH2OH的浓度为___ 。
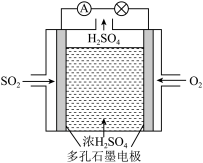
Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为___ 极,写出该电池负极的电极反应式___ 。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)
 CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1(1)下列措施中有利于增大该反应的反应速率的是
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g)
 CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1CO(g)+
 O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1H2(g)+
 O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3| 化学键 | H—H | O=O | O—H |
| 键能/KJ▪mol-1 | 436 | 498 | 463.5 |
则△H3=
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:(1)其平衡常数表达式为K=
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据分析:

①降低温度,平衡向
②在700K、起始投料比
 =1.5时,H2的转化率为
=1.5时,H2的转化率为③在500K、起始投料比
 =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH3CH2OH的浓度为
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH3CH2OH的浓度为Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为

您最近一年使用:0次



