名校
1 . 从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应;:
2NH3为放热反应;:
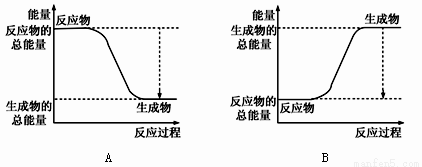
①下图能正确表示该反应中能量变化的是________ ;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______ kJ;
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______ ,反应开始与平衡时气体的物质的量之比为__________ ;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________ 。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________ 。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
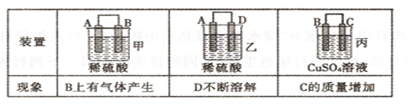
①装置甲中SO 向
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________ ;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______ mol。
(1)已知一定条件下,反应N2+3H2
 2NH3为放热反应;:
2NH3为放热反应;:①下图能正确表示该反应中能量变化的是

②根据下表数据,计算生成1molNH3时该反应放出的热量为
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO
 向
向②四种金属活动性由强到弱的顺序是
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为
您最近一年使用:0次
2018-07-07更新
|
822次组卷
|
2卷引用:【全国百强校】广西南宁市第三中学2017-2018学年高一下学期期末考试(理)化学试题
名校
解题方法
2 . 25℃时,有关物质的电离平衡常数如下:
(1)请写出H2SO3的电离平衡常数K1的表达式:________________ 。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____ 后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________ 。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________ 。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____ (填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________ 。
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为
您最近一年使用:0次
2018-01-26更新
|
990次组卷
|
6卷引用:广西陆川县中学2017-2018学年高二上学期期末考试化学试题
3 . 下列说法不正确的是
| A.配制FeCl2溶液时,可将FeCl2晶体先溶于浓盐酸,再加水稀释和少量铁屑保存 |
| B.输油管道,为防止其表面被腐蚀应涂上隔水材料并与外电源负极相连 |
| C.pH值均为9的NaOH溶液和Na2CO3溶液,两溶液中水的电离程度相同 |
| D.0.1mol/L弱酸HA溶液与0.05mol/LNaOH溶液等体积混合后所得溶液微粒浓度间有:2c(H+)+c(HA)=c(A-)+2c(OH-) |
您最近一年使用:0次
2017-07-13更新
|
222次组卷
|
3卷引用:广西钦州市钦州港经济技术开发区2016-2017学年高二下学期期末考试化学试题
广西钦州市钦州港经济技术开发区2016-2017学年高二下学期期末考试化学试题安徽省定远县育才学校2019-2020学年高二4月月考化学试题(已下线)本册综合检测(一)——2020-2021学年高二化学选修四同步单元AB卷(人教版)



