名校
解题方法
1 . 为了缓解温空效应,科学家提出了多种回收和利用CO2的方案。
(1)方案1: 利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 =+113. 4kJ/mol
请写出由FeO制备H2的热化学方程式_________________ 。
方案2: 利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2发生反应: CO2(g)+4H2(g) CH4(g)+ 2H2O(g) ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+ 2H2O(g) ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
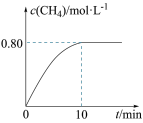
(2)① 从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=_________________ 。
② 300℃时,反应的平衡常数K=_______________ 。
③ 300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g)。则v正____________ v逆(填“>”“<”或“=" )
(3)下列有关说法正确的是(填序号)_______________ 。
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.300℃时,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度等于1.6mo/L
D.每断开2molC=O键的同时断开4molC-H键,说明反应达到平衡状态
E.达到平衡后,分离出水蒸气,既能加快反应速率又能使平衡正方向移动
(4)已知200℃时,该反应的平衡常数K=64.8(L/mol)2。则ΔH4________ 0(填“>”“<”或“=”)。
方案3:利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:(假设开始时两极的质量相等)
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:(假设开始时两极的质量相等)

(5)①放电时,正极的电极反应式为_______________ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mole-时,两极的质量差为_____ g。
(1)方案1: 利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 =+113. 4kJ/mol
请写出由FeO制备H2的热化学方程式
方案2: 利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2发生反应: CO2(g)+4H2(g)
 CH4(g)+ 2H2O(g) ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+ 2H2O(g) ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
(2)① 从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=
② 300℃时,反应的平衡常数K=
③ 300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g)。则v正
(3)下列有关说法正确的是(填序号)
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.300℃时,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度等于1.6mo/L
D.每断开2molC=O键的同时断开4molC-H键,说明反应达到平衡状态
E.达到平衡后,分离出水蒸气,既能加快反应速率又能使平衡正方向移动
(4)已知200℃时,该反应的平衡常数K=64.8(L/mol)2。则ΔH4
方案3:利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:(假设开始时两极的质量相等)
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:(假设开始时两极的质量相等)
(5)①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mole-时,两极的质量差为
您最近一年使用:0次
2019-03-21更新
|
439次组卷
|
2卷引用:吉林省四平市双辽市第二中学2019-2020学年高二上学期期末考试化学试题
真题
名校
2 . 明矾石经处理后得到明矾【 KAl(SO4)2·12H2O】。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
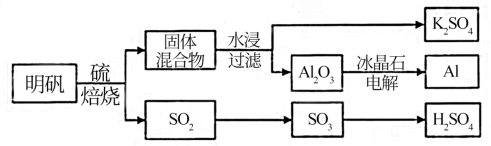
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________ 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________ 。
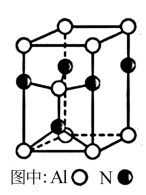
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____ 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________ 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________ 。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________ t。

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是
(2)从水浸后的滤液中得到K2SO4晶体的方法是

(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)
 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸
您最近一年使用:0次
2019-01-30更新
|
1179次组卷
|
10卷引用:2014届吉林省延边州高三上学期质量检测理综化学试卷
(已下线)2014届吉林省延边州高三上学期质量检测理综化学试卷2013年全国普通高等学校招生统一考试理科综合能力测试化学(四川卷)(已下线)2014届高考化学二轮复习必做训练 化工生产流程、无机物的判断练习卷(已下线)2013-2014北京101中学高三第三次月考理综化学试卷(已下线)2014届江西省金溪一中高三理科综合训练题(一)化学试卷2015届山东省济宁市金乡县第二中学高三4月质量检测化学试卷(已下线)2014届北京101中学高三年级第三次月考理综化学试卷贵州省余庆中学2019-2020学年上学期开学考试高三化学试题2020届高三化学二轮选修大题必练 — —— 以“化工流程”为载体的综合实验三轮冲刺2020届高三化学考题必刷——无机化合物制备的定量、定性分析题
名校
3 . 下列比较中前者大于后者的是
A | 不同情况下速率: A(g)+3B(g)  2C(g) 2C(g) | v(A)=0.15 mol/(L·min) | v(B)=0.06 mol/(L·s) |
| B | 加水稀释 10 倍后的 pH | 1 mL pH=1 的 CH3COOH | 1 mL pH=1 的 HCl |
C | 反应热△H | 50 mL 0.1 mol/L 的 NaOH 和 50 mL 0.1 mol/L 的 HCl | 50 mL 0.1 mol/L 的 NaOH 和 50 mL 0.1 mol/L CH3COOH |
D | 反应速率: Zn+2H+ ═ Zn2++H2↑ | 65 g 粗 Zn(含 Cu 等杂质)与 足量 1 mol/L 的 HCl 反应 | 65 g 纯 Zn 与足量 1 mol/L 的 盐酸反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-11更新
|
328次组卷
|
4卷引用:【校级联考】吉林省榆树一中五校联考2018-2019学年高二上学期期末联考化学试题
名校
4 . 下列有关概念和原理的说法正确的是
| A.酸和碱反应只能生成盐和水 |
| B.由14N和中子在宇宙射线影响下形成12C 为化学变化: 14N+1n→ 12C+ 3H |
| C.金属主要发生吸氧腐蚀,其本质是被氧化 |
| D.Na2O2的水溶液能导电,所以Na2O2是电解质 |
您最近一年使用:0次
名校
5 . 研究NO2、NO、CO、NO2-等污染物的处理,对环境保护有重要的意义。
(1)①NO2(g)+CO(g) CO2(g)+NO(g) △H1=-234.00kJ·mol-1
CO2(g)+NO(g) △H1=-234.00kJ·mol-1
②1/2N2(g)+1/2O2(g) NO(g) △H2=-89.75 kJ·mol-1
NO(g) △H2=-89.75 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) △H3=-112.30kJ·mol-1
2NO2(g) △H3=-112.30kJ·mol-1
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为__________________ 。
(2)某温度下,向10L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生反应:2NO2(g)+ 4CO(g) N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
①0~10min内,CO的平均反应速率v(CO)=___________ ;
②若容器中观察到____________________________ ,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为
________ ;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡________ (填“右移”或“左移”或“不移动”)。
(3)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是________ [用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。


②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因_____________________________________ (假设该温度范围内催化剂的催化效率相同)。
(4)有人设想在含有NO2-的酸性污水中加入填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_________________________________ 。
(1)①NO2(g)+CO(g)
 CO2(g)+NO(g) △H1=-234.00kJ·mol-1
CO2(g)+NO(g) △H1=-234.00kJ·mol-1②1/2N2(g)+1/2O2(g)
 NO(g) △H2=-89.75 kJ·mol-1
NO(g) △H2=-89.75 kJ·mol-1③2NO(g)+O2(g)
 2NO2(g) △H3=-112.30kJ·mol-1
2NO2(g) △H3=-112.30kJ·mol-1若NO2气体和CO气体反应生成无污染气体,其热化学方程式为
(2)某温度下,向10L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生反应:2NO2(g)+ 4CO(g)
 N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30①0~10min内,CO的平均反应速率v(CO)=
②若容器中观察到
③为增大污染物处理效率,起始最佳投料比为

④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡
(3)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是


②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因
(4)有人设想在含有NO2-的酸性污水中加入填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用
您最近一年使用:0次
2018-05-16更新
|
895次组卷
|
5卷引用:吉林省安图县第一中学2019届高三上学期期末考试化学试题
名校
解题方法
6 . 已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,pH相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________ (填序号)
(2)25°C时,pH=4的NH4Cl溶液中各离子浓度的大小关系为____________________ 。
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO‒)________ c(HCO3‒)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________ (填代号)
a.向NaClO溶液中加适量的水b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水d.向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为______________________ 。
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________ (填“酸性”“碱性”“中性”)
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(2)25°C时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO‒)
a.向NaClO溶液中加适量的水b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水d.向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性
您最近一年使用:0次
2018-02-25更新
|
305次组卷
|
6卷引用:吉林省四平市双辽市第二中学2019-2020学年高二上学期期末考试化学试题
名校
7 . 在一定温度下向不同电解质溶液中加入新物质时,溶液导电性会发生变化。下列图示中,电流强度(I)随新物质加入量(m)的变化趋势与实验过程相符合的是


| A.向CH3COOH溶液中逐渐通入NH3至过量 |
| B.向NH4Cl溶液中逐渐加入NaOH固体至过量 |
| C.向Ba(OH)2溶液中滴入等浓度的硫酸至过量 |
| D.向NaAlO2溶液中滴入等浓度的盐酸至过量 |
您最近一年使用:0次
2018-01-24更新
|
334次组卷
|
2卷引用:吉林省东北师范大学附属中学2017-2018学年高二上学期期末考试化学试题
名校
8 . 下列有关化学反应速率的说法正确的是
| A.100mL 2mol·L-1 的盐酸与锌反应时,加入适量的氯化钠溶液,反应速率不变 |
| B.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
| C.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
| D.合成氨反应中,增加氨气浓度对反应速率无影响 |
您最近一年使用:0次
9 . 某废水中含有CN-和Cr2O72- 等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:

回答下列问题:
(1)步骤②中,CN- 被ClO-氧化为CNO-的离子方程式为____________ 。
(2)步骤③的反应的离子方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________ mol电子。
(3)含Cr 3+废水可以加入熟石灰进一步处理,目的是___________________ 。

回答下列问题:
(1)步骤②中,CN- 被ClO-氧化为CNO-的离子方程式为
(2)步骤③的反应的离子方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去
(3)含Cr 3+废水可以加入熟石灰进一步处理,目的是
您最近一年使用:0次
2018-01-20更新
|
212次组卷
|
2卷引用:吉林省安图县中学2017-2018学年高一上学期期末考试化学试题
名校
10 . 下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是
| A.氢氧化钠与二氧化碳反应 | B.盐酸和碳酸氢钠溶液 |
| C.铜与硝酸反应 | D.氯化铝溶液和氢氧化钠溶液反应 |
您最近一年使用:0次
2018-01-20更新
|
311次组卷
|
4卷引用:吉林省安图县中学2017-2018学年高一上学期期末考试化学试题



