1 . 铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
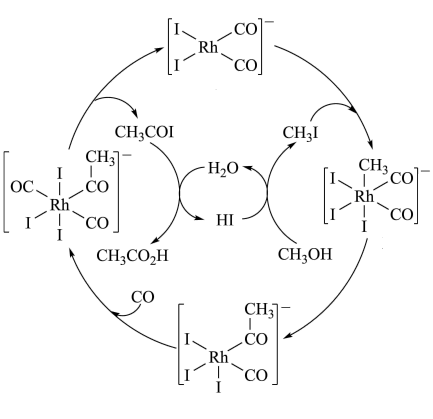
| A.CH3COI是反应中间体 |
| B.甲醇羰基化反应为CH3OH+CO=CH3CO2H |
| C.反应过程中Rh的成键数目保持不变 |
| D.存在反应CH3OH+HI=CH3I+H2O |
您最近一年使用:0次
2020-07-08更新
|
17480次组卷
|
48卷引用:黑龙江省哈尔滨市第一二二中学2021-2022学年高三假期检验性考试化学试题
黑龙江省哈尔滨市第一二二中学2021-2022学年高三假期检验性考试化学试题2020年全国统一考试化学试题(新课标Ⅰ)(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编(已下线)第13讲 原子结构和化学键-2021年高考化学一轮复习名师精讲练河南省郑州市巩义市第四高级中学2021届高三上学期期中考试化学试题(已下线)小题必刷21 原子结构与化学键——2021年高考化学一轮复习小题必刷(通用版)天津市和平区2020-2021学年高二下学期期末考试化学试题2020年全国卷Ⅰ理综化学高考真题变式题黑龙江省大庆市东风中学2022-2023学年高三上学期第一次月考化学试题(已下线)热点10 新信息反应机理分析-2021年高考化学专练【热点·重点·难点】(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)热点7 新信息反应机理分析-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)课时27 微粒间作用力-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点38 烃的含氧衍生物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点38 卤代烃 醇 酚-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点39 醛 羧酸 酯-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷08 元素周期律-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)安徽省合肥市普通高中六校联盟2021-2022学年高二下学期期中联考化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏加德罗常数-备战2022年高考化学临考题号押题(全国卷)(已下线)查补易混易错点01 物质的组成、性质、分类及化学用语-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题07化学反应中的能量变化及反应机理-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题07化学反应中的能量变化及反应机理-五年(2018~2022)高考真题汇编(全国卷)北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)专题1 揭示物质结构的奥秘 ★第一~三单元综合拔高练四川省内江市第六中学2021-2022学年高二下学期入学考试(创新班)化学试题新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题(已下线)第18讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河南省洛阳市新安县第一高级中学2022-2023学年高三上学期入学测试(实验小班)化学试题湖南省邵阳市洞口县第一中学2021-2022学年高三下学期第三次模拟考试化学试题北京市中国人民大学附属中学2022-2023学年高三上学期统练6化学试题(已下线)广东省深圳中学2023届高三年级上学期第二次阶段测试化学试题(A卷)(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻3 化学反应历程图像分析内蒙古赤峰二中2022-2023学年高二下学期第一次月考化学试题广东省2021届高三下学期模拟预热化学试题(已下线)专题10 物质的反应及转化(已下线)热点题型训练 催化剂与反应历程(机理)广东省汕头市金山中学2023-2024学年高二上学期10月阶段考试 化学 Word版含答案(已下线)T12-物质反应及转化江苏省南京市人民中学 海安实验中学 句容三中2023-2024学年高二下学期3月月考化学试题
名校
解题方法
2 . 学习小组设计如图所示装置,进行NO和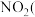 假设二者物质的量之比为
假设二者物质的量之比为 的处理并制取硝酸。下列说法正确的是
的处理并制取硝酸。下列说法正确的是

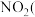 假设二者物质的量之比为
假设二者物质的量之比为 的处理并制取硝酸。下列说法正确的是
的处理并制取硝酸。下列说法正确的是 
| A.ab适宜选用阴离子交换膜 |
| B.该电池工作时,正极区溶液的pH减小 |
C.导线中流过 电子的电量时,有 电子的电量时,有 离子通过交换膜 离子通过交换膜 |
D.负极的电极反应式为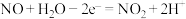 |
您最近一年使用:0次
2020-02-24更新
|
459次组卷
|
4卷引用:黑龙江省大庆实验中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
3 . 固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子 如
如 提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图
提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图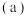 所示的锂超离子导体
所示的锂超离子导体 和图
和图 所示的有“点缺陷”的NaCl。
所示的有“点缺陷”的NaCl。
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态Cl的________ 能级,此过程会_______  填“吸收”或“释放”
填“吸收”或“释放” 能量。
能量。
(2)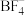 中B的杂化形式为
中B的杂化形式为__________ ,其等电子体为:___________  任写一种
任写一种 。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是
。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是____________ 。
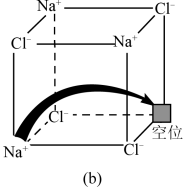
(3)图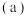 所示晶胞中
所示晶胞中 位于
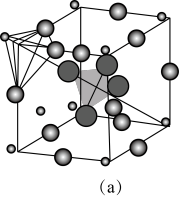
位于__________ 位置;若将晶体中形成宽敞通道的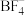 换成
换成 ,导电能力会明显降低,原因是
,导电能力会明显降低,原因是_____________ 。
(4)图 中,若缺陷处填充了
中,若缺陷处填充了 ,则它
,则它____________  填“是”或“不是”
填“是”或“不是”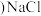 的晶胞,在NaCl晶体中,
的晶胞,在NaCl晶体中, 填充在
填充在 堆积而成的
堆积而成的___________ 面体空隙中。
 如
如 提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图
提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图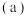 所示的锂超离子导体
所示的锂超离子导体 和图
和图 所示的有“点缺陷”的NaCl。
所示的有“点缺陷”的NaCl。


根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态Cl的
 填“吸收”或“释放”
填“吸收”或“释放” 能量。
能量。(2)
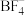 中B的杂化形式为
中B的杂化形式为 任写一种
任写一种 。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是
。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是(3)图
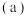 所示晶胞中
所示晶胞中 位于
位于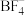 换成
换成 ,导电能力会明显降低,原因是
,导电能力会明显降低,原因是(4)图
 中,若缺陷处填充了
中,若缺陷处填充了 ,则它
,则它 填“是”或“不是”
填“是”或“不是” 的晶胞,在NaCl晶体中,
的晶胞,在NaCl晶体中, 填充在
填充在 堆积而成的
堆积而成的
您最近一年使用:0次
4 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___ 。
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___ mol•L-1•min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
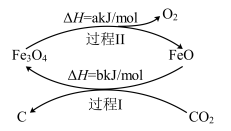
①在转化过程中起催化作用的物质是___ ;
②写出总反应的化学方程式___ 。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H___ 0。(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___ ;B点处,NH3的平衡转化率为___ 。
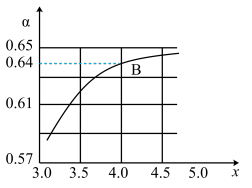
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)
 C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g)
 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的
 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
您最近一年使用:0次
2019-12-06更新
|
709次组卷
|
6卷引用:黑龙江省牡丹江市第一高级中学2021届高三上学期期末化学试题
名校
解题方法
5 . CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(1)△H1=akJ•mol-1
O2(g)=CO2(g)+2H2O(1)△H1=akJ•mol-1
H2(g)+ O2(g)=H2O(1)△H2=bkJ•mol-1
O2(g)=H2O(1)△H2=bkJ•mol-1
H2O(g)=H2O(l) △H3=ckJ•mol-1
则CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=
CH3OH(g)+H2O(g) △H=__________ kJ•mol-1
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g)
2CO(g) H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。

回答下列问题:
①压强 p1、p2、p3的大小关系是________ ;Ka、Kb、Kc为a、b、c三点对应的平衡常数,则其大小关系是_________ 。
②900℃、1.0 MPa时,足量碳与a molCO2反应达平衡后,CO2的转化率为___________ (保留三位有效数字),该反应的平衡常数Kp=_________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g) CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_____________ ;300~400℃时,乙酸的生成速率升高的主要原因是___________ 。
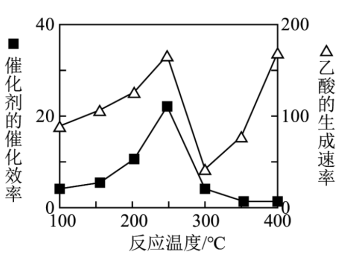
②为了提高该反应中CO2的转化率,可以采取的措施是_____ (写一条即可)。
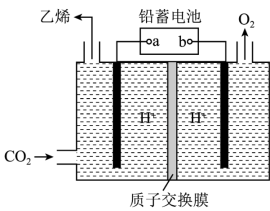
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为___________ ;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_____ mol硫酸。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+
 O2(g)=CO2(g)+2H2O(1)△H1=akJ•mol-1
O2(g)=CO2(g)+2H2O(1)△H1=akJ•mol-1H2(g)+
 O2(g)=H2O(1)△H2=bkJ•mol-1
O2(g)=H2O(1)△H2=bkJ•mol-1H2O(g)=H2O(l) △H3=ckJ•mol-1
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=
CH3OH(g)+H2O(g) △H=(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)
 2CO(g)
2CO(g) H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
回答下列问题:
①压强 p1、p2、p3的大小关系是
②900℃、1.0 MPa时,足量碳与a molCO2反应达平衡后,CO2的转化率为
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)
 CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是
②为了提高该反应中CO2的转化率,可以采取的措施是
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为

您最近一年使用:0次
2019-12-05更新
|
301次组卷
|
2卷引用:黑龙江省哈尔滨工业大学附属中学2020-2021学年度高二下学期期末考试化学试题
名校
6 . 下列叙述中正确的是
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023 |
| C.工业制粗硅2C(s)+SiO2(s)===Si(s)+2CO(g),室温下不能自发进行,则△H>0 |
| D.稀盐酸和稀氢氧化钠反应的中和热为-57.3 kJ•mol-1,则稀醋酸和稀氨水反应的中和热也为-57.3kJ·mol-1 |
您最近一年使用:0次
2019-07-01更新
|
936次组卷
|
7卷引用:黑龙江省牡丹江市东部地区四校联考2019-2020学年高二上学期期末考试化学试题
真题
名校
7 . 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
| A.一定温度下,反应2H2(g)+O2(g) =2H2O(g)能自发进行,该反应的ΔH<0 |
| B.氢氧燃料电池的负极反应为O2+2H2O+4e−=4OH− |
| C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023 |
| D.反应2H2(g)+O2(g) =2H2O(g)的ΔH可通过下式估算:∆H=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和 |
您最近一年使用:0次
2019-06-10更新
|
5085次组卷
|
30卷引用:黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题
黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题2019年江苏省高考化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编山西省祁县第二中学校2020届高三上学期期中考试化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题陕西省西安中学2020届高三上学期第三次月考化学试题2019年秋高三化学复习强化练习——化学反应的方向及判断(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题(已下线)第六章能力提升检测卷-2021年高考化学一轮复习讲练测江苏省镇江市吕叔湘中学2019-2020学年高二下学期期中考试化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)重庆市缙云教育联盟2020-2021学年高二上学期期末考试化学试题湖北省荆州中学2020-2021学年高二12月月考化学试题辽宁省沈阳市郊联体2021届高三上学期期末考试化学试题(已下线)【镇江新东方】高二下21心湖期中安徽省淮北市树人高级中学2020-2021学年高二上学期第四阶段考试化学试题福建省厦门第一中学2020-2021学年高二上学期期中考试化学试题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)【浙江新东方】高中化学20210304-003(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2019年高考江苏卷化学试题变式题(不定项选择题)天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题
名校
8 . 随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
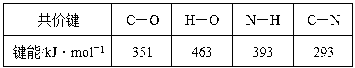
则该反应的ΔH=____ kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
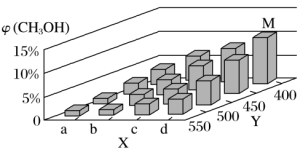
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____ 。
②X轴上a点的数值比b点_____ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_________ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为______ 。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=___ ;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq) PbI2(s)+2Cl-(aq)的平衡常数K=
PbI2(s)+2Cl-(aq)的平衡常数K=_______ 。
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
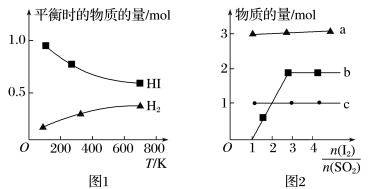
①反应H2(g)+I2(g) 2HI (g)的ΔH
2HI (g)的ΔH_____ (填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I- I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是_____ 、_____ (填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是_______ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=
 PbI2(s)+2Cl-(aq)的平衡常数K=
PbI2(s)+2Cl-(aq)的平衡常数K=(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)
 2HI (g)的ΔH
2HI (g)的ΔH②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O
 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I- I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是
您最近一年使用:0次
名校
9 . 下列说法正确的是
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)的ΔS<0 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl |
| D.等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
您最近一年使用:0次
名校
10 . 请应用化学反应原理的相关知识解决下列问题
(1)已知NaCl的溶解热为3.8kJ·mol-1(吸热)
Na(s)-e-====Na+(aq) △H=-240 kJ/mol
 Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
写出钠在氯气中燃烧的热化学方程式_______________________ 。
(2)一定条件下,在2L恒容密闭容器中充入1.5 mol CO2和3molH2发生反应:CO2(g)+3H2(g) CH3OH(g) +H3O(g)
CH3OH(g) +H3O(g)
下图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500K的条件下,该反应l0min达到平衡;

①该反应是__________ (填“吸热”或“放热”)反应。
②在0~10min时段反应速率v(H2)为__________ 。
③若改充入2 mol CO2和3molH2,图中的曲线会__________ (填“上移”或“下移”)。
(3)根据下表数据回答问题:
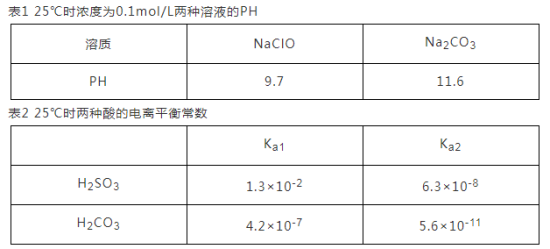
①根据表1能不能判断出H2CO3与HClO酸性强弱?_________ (填“能”或“不能”)。
②0.10mol·L-lNa2SO3溶液中离子浓度由大到小的顺序为___________________________ 。
③H2SO3溶液和 NaHCO3溶液反应的离子方程式为________________________________ 。
(4)已知:t℃时,Ksp(AgCl)=1.5×10-10、Ksp (Ag2CrO4)=2.0×10-12;AgCl为白色沉淀,Ag2CrO4为砖红色沉淀,t℃时,向Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为_____________________________________________ 。
(1)已知NaCl的溶解热为3.8kJ·mol-1(吸热)
Na(s)-e-====Na+(aq) △H=-240 kJ/mol
 Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol写出钠在氯气中燃烧的热化学方程式
(2)一定条件下,在2L恒容密闭容器中充入1.5 mol CO2和3molH2发生反应:CO2(g)+3H2(g)
 CH3OH(g) +H3O(g)
CH3OH(g) +H3O(g)下图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500K的条件下,该反应l0min达到平衡;

①该反应是
②在0~10min时段反应速率v(H2)为
③若改充入2 mol CO2和3molH2,图中的曲线会
(3)根据下表数据回答问题:

①根据表1能不能判断出H2CO3与HClO酸性强弱?
②0.10mol·L-lNa2SO3溶液中离子浓度由大到小的顺序为
③H2SO3溶液和 NaHCO3溶液反应的离子方程式为
(4)已知:t℃时,Ksp(AgCl)=1.5×10-10、Ksp (Ag2CrO4)=2.0×10-12;AgCl为白色沉淀,Ag2CrO4为砖红色沉淀,t℃时,向Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为
您最近一年使用:0次



