解题方法
1 . 丙烯是石油化学工业的重要基础原料,我国科学家利用甲醇制丙烯的反应过程如下:3CH3OH+H3AlO6→3 +
+ +3H2O、3
+3H2O、3 +
+ →H3AlO6+3CH2、3CH2→CH2=CHCH3,下列叙述错误的是
→H3AlO6+3CH2、3CH2→CH2=CHCH3,下列叙述错误的是
 +
+ +3H2O、3
+3H2O、3 +
+ →H3AlO6+3CH2、3CH2→CH2=CHCH3,下列叙述错误的是
→H3AlO6+3CH2、3CH2→CH2=CHCH3,下列叙述错误的是A.甲基碳正离子 的电子式为 的电子式为 |
| B.1.4g CH2所含的电子的物质的量为 1mol |
| C.甲醇制丙烯反应的过程中 H3AlO6作催化剂 |
| D.甲醇制丙烯的方程式为 3CH3OH→CH2=CHCH3+3H2O |
您最近一年使用:0次
名校
解题方法
2 . 2019年国际非政府组织“全球计划”12月4日发布报告:CO2过量排放会引发温室效应,CO2资源化的高效利用是解决温室问题的有效途径。
(1)CO2可通过催化加氢合成甲醇(CH3OH),其相关反应在不同温度下的化学平衡常数如下表所示。
①判断反应III:ΔH_____ 0(填“>”、“<”或“=”);
②根据反应III的特点,有利于提高甲醇平衡产率的条件是______ ;
A高压高温 B低压高温 C高压低温 D低压低温
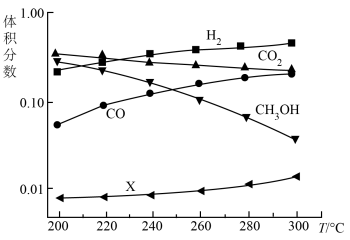
③5MPa时,往某密闭容器中充入H2和CO2发生反应,平衡体系中各组分的体积分数随温度的变化情况如图所示。由图可知,随温度的升高,CO2的体积分数逐渐减小,其原因为:_____________ ;
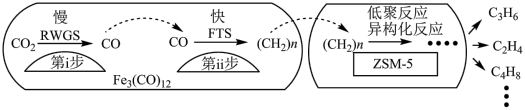
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_____ 助剂效果最好;
②下列说法正确的是____ :
a.第i步反应为:CO2+H2 CO+H2O
CO+H2O
b.第i步反应的活化能低于第ii步
c.加入助剂能提高单位时间内乙烯产量的原因是降低生成乙烯的反应所需要的活化能
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
(1)CO2可通过催化加氢合成甲醇(CH3OH),其相关反应在不同温度下的化学平衡常数如下表所示。
| 化学反应 | 平衡常数 | ||
| 500℃ | 700℃ | 800℃ | |
I.H2(g+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | 1.00 | 1.50 | 2.50 |
II.2H2(g)+CO(g) CH3OH(g) CH3OH(g) | 2.00 | 0.5 | 0.25 |
III.3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH CH3OH(g)+H2O(g) ΔH | |||
①判断反应III:ΔH
②根据反应III的特点,有利于提高甲醇平衡产率的条件是
A高压高温 B低压高温 C高压低温 D低压低温
③5MPa时,往某密闭容器中充入H2和CO2发生反应,平衡体系中各组分的体积分数随温度的变化情况如图所示。由图可知,随温度的升高,CO2的体积分数逐渐减小,其原因为:

(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加
②下列说法正确的是
a.第i步反应为:CO2+H2
 CO+H2O
CO+H2Ob.第i步反应的活化能低于第ii步
c.加入助剂能提高单位时间内乙烯产量的原因是降低生成乙烯的反应所需要的活化能
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
您最近一年使用:0次
解题方法
3 . 氮及其化合物在化肥、医药、材料和国防工业中具有广泛应用。回答下列问题:
(1)自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。写出实验室制备氨气的方程式_________ 。
(2)有人设想寻求合适的催化剂和电极材料,以 、
、 为电极反应物,以
为电极反应物,以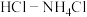 为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。

①a电极是该电池的_______ (填正极或者负极);该电池正极的电极反应式是___________ 。
②该电池在工作过程中 的浓度将不断
的浓度将不断_________ (填增大或减小),假设放电过程中电解质溶液的体积不变,当溶液中 的物质的量改变
的物质的量改变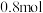 时,理论上电池能为外电路提供
时,理论上电池能为外电路提供___________ mol电子。
(3)肼 又称为联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池以20%~30%的
又称为联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池以20%~30%的 溶液为电解质溶液,总反应方程式为:
溶液为电解质溶液,总反应方程式为: 。请写出该电池放电时,负极的电极反应式:
。请写出该电池放电时,负极的电极反应式:__________ 。
(4)为了监测空气中NOx的含量,科学家成功研制出了一种NOx传感器,其工作原理示意图如图:
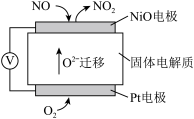
①固体电解质中 移向
移向___________ (填“正极”或“负极”)
②写出 电极发生的电极反应式:
电极发生的电极反应式:________ 。
(1)自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。写出实验室制备氨气的方程式
(2)有人设想寻求合适的催化剂和电极材料,以
 、
、 为电极反应物,以
为电极反应物,以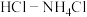 为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
①a电极是该电池的
②该电池在工作过程中
 的浓度将不断
的浓度将不断 的物质的量改变
的物质的量改变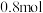 时,理论上电池能为外电路提供
时,理论上电池能为外电路提供(3)肼
 又称为联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池以20%~30%的
又称为联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池以20%~30%的 溶液为电解质溶液,总反应方程式为:
溶液为电解质溶液,总反应方程式为: 。请写出该电池放电时,负极的电极反应式:
。请写出该电池放电时,负极的电极反应式:(4)为了监测空气中NOx的含量,科学家成功研制出了一种NOx传感器,其工作原理示意图如图:

①固体电解质中
 移向
移向②写出
 电极发生的电极反应式:
电极发生的电极反应式:
您最近一年使用:0次
解题方法
4 . 下列关于无机物应用的叙述正确的是( )
A. 湿法脱除烟气中的NO,是利用 湿法脱除烟气中的NO,是利用 的氧化性 的氧化性 |
B.半导体工业中可用氢氟酸除去硅片表面的 层,是因为HF具有强酸性 层,是因为HF具有强酸性 |
C. 法利用 法利用 溶液脱除烟气中的 溶液脱除烟气中的 ,是利用 ,是利用 溶液呈酸性 溶液呈酸性 |
D.用氨水除去铜器表面的 转化为 转化为 ,是利用 ,是利用 的还原性 的还原性 |
您最近一年使用:0次
2020-01-26更新
|
105次组卷
|
2卷引用:重庆市乌江新高考协作体2023-2024学年高一上学期期末学业质量联合调研抽测化学试题
真题
名校
5 . 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
| A.一定温度下,反应2H2(g)+O2(g) =2H2O(g)能自发进行,该反应的ΔH<0 |
| B.氢氧燃料电池的负极反应为O2+2H2O+4e−=4OH− |
| C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023 |
| D.反应2H2(g)+O2(g) =2H2O(g)的ΔH可通过下式估算:∆H=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和 |
您最近一年使用:0次
2019-06-10更新
|
5085次组卷
|
30卷引用:重庆市缙云教育联盟2020-2021学年高二上学期期末考试化学试题
重庆市缙云教育联盟2020-2021学年高二上学期期末考试化学试题2019年江苏省高考化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编山西省祁县第二中学校2020届高三上学期期中考试化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题陕西省西安中学2020届高三上学期第三次月考化学试题2019年秋高三化学复习强化练习——化学反应的方向及判断(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题(已下线)第六章能力提升检测卷-2021年高考化学一轮复习讲练测江苏省镇江市吕叔湘中学2019-2020学年高二下学期期中考试化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)湖北省荆州中学2020-2021学年高二12月月考化学试题辽宁省沈阳市郊联体2021届高三上学期期末考试化学试题黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题(已下线)【镇江新东方】高二下21心湖期中安徽省淮北市树人高级中学2020-2021学年高二上学期第四阶段考试化学试题福建省厦门第一中学2020-2021学年高二上学期期中考试化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)【浙江新东方】高中化学20210304-003(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2019年高考江苏卷化学试题变式题(不定项选择题)天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题
名校
解题方法
6 . (1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________ (填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________ kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________ mol/(L·s);
②若将该容器置于冰水中,气体颜色将________ (填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________ 。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________ (填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______ c(HSO3-)(填“>”“<”或“=”)。
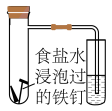
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
①几分钟后,可观察到导管中的水柱________ ;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________ ;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________ 。
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:
②CO(g)+1/2O2(g)=CO2(g) ΔH=
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)
 N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:①5秒内,v(NO2)=
②若将该容器置于冰水中,气体颜色将
③该反应的平衡常数表达式K=
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈
②溶液中c(Na+)
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
①几分钟后,可观察到导管中的水柱
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为
您最近一年使用:0次
2019-03-24更新
|
352次组卷
|
5卷引用:河北省秦皇岛市卢龙中学2018-2019学年高二下学期期末考试化学试题
7 . 氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___ 92.2kJ(填“>”、“=”或“<”),原因是_______________ 。
②使用催化剂,该反应△H_____ (填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为_____ kJ.
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________________ 。
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
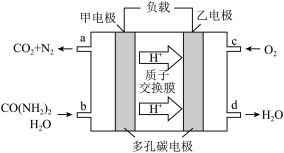
回答下列问题:
电池中的负极为_____ (填“甲”或“乙”),甲的电极反应式为_____________ ,
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_____ L。
(1)已知:N2(g)+3H2(g)
 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
②使用催化剂,该反应△H
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:

回答下列问题:
电池中的负极为
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为
您最近一年使用:0次
名校
解题方法
8 . 镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、 GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________ 。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________ 。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+ NH3(g)=GaN(s)+3HCl(g) ∆H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g) ∆H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) ∆H3
由上述反应可知∆H3=_____________ 。
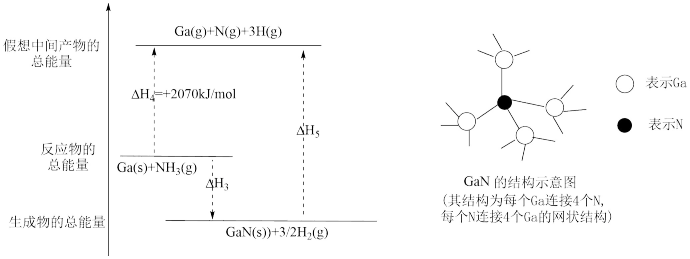
已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____ molGa-N键,拆开lmolGa-N键所需能量为______ kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:
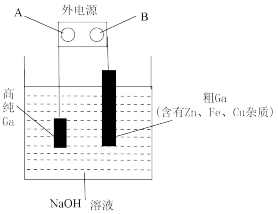
已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____ 极,电解精炼镓时产生阳极泥的主要成分是___________ 。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________ 。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________ 。(η=生成目标产物消耗的电子数÷转移的电子总数)。
(1)请画出Ga的原子结构示意图
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+ NH3(g)=GaN(s)+3HCl(g) ∆H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g) ∆H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) ∆H3
由上述反应可知∆H3=

已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:

已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=
您最近一年使用:0次
名校
9 . 常温下,已知:CH4(g)+2O2(g)=CO2(g)+2H2O(1) ∆H=-980kJ/mol
2H2(g)+O2(g)=2H2O(1) △H=-560kJ/mol
现有CH4和H2组成的混合气体共0.4mol,使其在O2中完全燃烧,恢复至常温共放出252kJ的热量,则CH4与H2的物质的量之比是
2H2(g)+O2(g)=2H2O(1) △H=-560kJ/mol
现有CH4和H2组成的混合气体共0.4mol,使其在O2中完全燃烧,恢复至常温共放出252kJ的热量,则CH4与H2的物质的量之比是
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |
您最近一年使用:0次
2018-07-13更新
|
396次组卷
|
3卷引用:【全国百强校】重庆市第一中学2017-2018学年高一下学期期末考试化学试题
名校
10 . 在容积为0.4L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
(1)该反应的△H_______ 0(填“>”或“<”下同)。
(2)100℃时,体系中各物质浓度随时间变化如图所示。

在0~60s时段,反应速率v(N2O4)为__________ ;反应的平衡常数K的值为_________ 。反应达平衡后,再向容器中充入0.4molN2O4。平衡向_________ (填“正反应”或“逆反应”)方向移动,再次达到平衡时,N2O4的转化率与原平衡相比_________ (填“变大”“变小”或“不变”)。
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则反应达平衡之前v正_____ v逆。
 2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:(1)该反应的△H
(2)100℃时,体系中各物质浓度随时间变化如图所示。

在0~60s时段,反应速率v(N2O4)为
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则反应达平衡之前v正
您最近一年使用:0次



