名校
解题方法
1 . 电化学原理在工业生产中发挥着巨大的作用。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4

①阳极的电极反应式为_______
②阴极产生的气体为________
③右侧的离子交换膜为________ (填“阴”或“阳”)离子交换膜,阴极区a%_______ b%(填“>”“=”或“<”)
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH )
)_________ (填“>”“<”或“=”)c(NO )。
)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为_______ 。
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是______ g。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4

①阳极的电极反应式为
②阴极产生的气体为
③右侧的离子交换膜为
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH
 )
) )。
)。②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是
您最近一年使用:0次
2020-10-18更新
|
1014次组卷
|
2卷引用:广东省珠海市2020-2021学年高二上学期期末考试化学试题
解题方法
2 . Cu2O是重要的化工原料,主要用于制造船底防污漆、杀虫剂等。回答下列问题:
(1)氧化亚铜制备
①用CuO与Cu在900℃高温烧结可得Cu2O。
已知:2Cu(s)+O2(g)=2CuO(s) △H1=-314kJ•mol-1
2Cu2O(s)+O2(g)=4CuO(s) △H2=-292kJ•mol-1
则反应CuO(s)+Cu(s)=Cu2O(s)的△H3=___ kJ•mol-1。
②肼还原制备Cu2O。方法如下:将3~5mL浓度为20%N2H4(肼)水溶液倒入50mL高浓度醋酸铜水溶液中,使Cu2+被还原,并产生氮气。将生成的Cu2O沉淀用水、乙醇和乙醚洗涤。
生成Cu2O的离子方程式为_____ ;肼不宜过量,可能的原因是___ 。
③电解法制备Cu2O流程如图:

电解时阳极生成Cu2Cl2的电极反应式为____ ,Cu2Cl2在溶液中生成Cu2O的化学方程式为___ 。
(2)Cu2O与ZnO组成的催化剂可用于催化合成甲醇[CO(g)+2H2(g) CH3OH(g)]。将H2和CO按
CH3OH(g)]。将H2和CO按 =2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:
=2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:

①随着温度的升高,该反应的平衡常数____ (填“增大”“减小”或“不变”);图中压强由大到小的顺序为____ 。
②提高CO的平衡转化率除温度和压强外,还可采取的措施是___ 。
(1)氧化亚铜制备
①用CuO与Cu在900℃高温烧结可得Cu2O。
已知:2Cu(s)+O2(g)=2CuO(s) △H1=-314kJ•mol-1
2Cu2O(s)+O2(g)=4CuO(s) △H2=-292kJ•mol-1
则反应CuO(s)+Cu(s)=Cu2O(s)的△H3=
②肼还原制备Cu2O。方法如下:将3~5mL浓度为20%N2H4(肼)水溶液倒入50mL高浓度醋酸铜水溶液中,使Cu2+被还原,并产生氮气。将生成的Cu2O沉淀用水、乙醇和乙醚洗涤。
生成Cu2O的离子方程式为
③电解法制备Cu2O流程如图:

电解时阳极生成Cu2Cl2的电极反应式为
(2)Cu2O与ZnO组成的催化剂可用于催化合成甲醇[CO(g)+2H2(g)
 CH3OH(g)]。将H2和CO按
CH3OH(g)]。将H2和CO按 =2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:
=2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:
①随着温度的升高,该反应的平衡常数
②提高CO的平衡转化率除温度和压强外,还可采取的措施是
您最近一年使用:0次
3 . 甲酸钠是一种重要的化工原料。在0.5L真空密闭耐压容器中,将预先用95%乙醇水溶液配制的0.2LNaOH溶液加入上述耐压容器中,加热并搅拌,达到60℃恒温时,通入CO至一定压强,开始反应后记录容器内压强随时间的变化,直到压强不再变化后,冷却,泄压,取出反应物,抽滤烘干并称量。其反应如下:
I:CO(g)+H2O(l) HCOOH(aq) K1 △H1
HCOOH(aq) K1 △H1
II:HCOOH(aq)+NaOH(aq) HCOONa(s)+H2O(l) K2 △H2
HCOONa(s)+H2O(l) K2 △H2
III:CO(g)+NaOH(aq) HCOONa(s) K3 △H3
HCOONa(s) K3 △H3
回答下列问题:
(1)K3=__ (用含K1、K2的代数式表示),△H3=__ (用含△H1、△H2的代数式表示)。
(2)若需加快反应I的速率,下列措施可行的是__ (填标号)。
A.增大CO的初始压强 B.适当升高温度
C.减少乙醇浓度 D.降低搅拌转速
(3)利用反应CO(g)+NaOH(aq) HCOONa(s)在一定条件下可制取HCOONa,在恒温60℃以投料比均为n(NaOH):n(CO)=0.7投料,CO的初始压强分别为0.5MPa、1.5MPa、2.0MPa时,测得CO的转化率X(CO)与时间t的关系如图所示,则:
HCOONa(s)在一定条件下可制取HCOONa,在恒温60℃以投料比均为n(NaOH):n(CO)=0.7投料,CO的初始压强分别为0.5MPa、1.5MPa、2.0MPa时,测得CO的转化率X(CO)与时间t的关系如图所示,则:

①图中表示2.0MPa的曲线为__ (填字母)。
②写出HCOONa水解的离子方程式:___ 。
③写出提高HCOONa产率的一条措施:__ 。
I:CO(g)+H2O(l)
 HCOOH(aq) K1 △H1
HCOOH(aq) K1 △H1II:HCOOH(aq)+NaOH(aq)
 HCOONa(s)+H2O(l) K2 △H2
HCOONa(s)+H2O(l) K2 △H2III:CO(g)+NaOH(aq)
 HCOONa(s) K3 △H3
HCOONa(s) K3 △H3回答下列问题:
(1)K3=
(2)若需加快反应I的速率,下列措施可行的是
A.增大CO的初始压强 B.适当升高温度
C.减少乙醇浓度 D.降低搅拌转速
(3)利用反应CO(g)+NaOH(aq)
 HCOONa(s)在一定条件下可制取HCOONa,在恒温60℃以投料比均为n(NaOH):n(CO)=0.7投料,CO的初始压强分别为0.5MPa、1.5MPa、2.0MPa时,测得CO的转化率X(CO)与时间t的关系如图所示,则:
HCOONa(s)在一定条件下可制取HCOONa,在恒温60℃以投料比均为n(NaOH):n(CO)=0.7投料,CO的初始压强分别为0.5MPa、1.5MPa、2.0MPa时,测得CO的转化率X(CO)与时间t的关系如图所示,则:
①图中表示2.0MPa的曲线为
②写出HCOONa水解的离子方程式:
③写出提高HCOONa产率的一条措施:
您最近一年使用:0次
名校
解题方法
4 . 某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中不正确的是( )
| A.夏天,打开啤酒瓶时会在瓶口逸出气体,可以用勒夏特列原理加以解释 |
| B.使用催化剂既不会改变反应的限度也不会改变反应的焓变 |
| C.吸热反应就是反应物的总能量比生成物的总能量低;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少 |
| D.电解质溶液的导电能力与溶液中的离子浓度及离子所带电荷多少有关 |
您最近一年使用:0次
2020-08-19更新
|
436次组卷
|
6卷引用:云南省保山市中小学2019-2020学年高二下学期期末教育教学质量监测化学试题
解题方法
5 . 甲醇是一种重要的化工原料,工业上经常利用CO2与H2催化合成甲醇,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)已知该反应中,各反应物与生成物的键能数据如表所示:
则上述反应的ΔH=______ kJ•mol-1。
(2)在恒温条件下,将1molCO2与1molH2通入容积为1L的恒容密闭容器中发生反应,下列能说明该反应已达平衡的是______ (填选项字母)。
A.CO2的物质的量百分数保持不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.v正(CO2)=3v逆(H2)
(3)合成甲醇的H2可以用CH4与水蒸气在一定条件下来制取,其反应原理为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)ΔH=+203kJ•mol-1。在容积为3L的恒容密闭容器中通入3molCH4和3mol水蒸气,在一定条件下发生上述反应。达到平衡后,测得H2的体积分数与温度及压强的关系如图所示。

比较p1与p2的相对大小:p1______ p2(选填“>”“<”或“=”)。N点所对应的温度下该反应的平衡常数K=______ mol2•L-2
(4)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。

①图中b极要连接电源的______ (选填“正”或“负”)极,B口流出的物质是______ 。
② 放电的电极反应式为
放电的电极反应式为______ 。
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。(1)已知该反应中,各反应物与生成物的键能数据如表所示:
| 化学键 | H—H | C—O | O—H | C—H | C=O |
| 键能/(kJ•mol-l) | 436 | 326 | 464 | 414 | 803 |
则上述反应的ΔH=
(2)在恒温条件下,将1molCO2与1molH2通入容积为1L的恒容密闭容器中发生反应,下列能说明该反应已达平衡的是
A.CO2的物质的量百分数保持不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.v正(CO2)=3v逆(H2)
(3)合成甲醇的H2可以用CH4与水蒸气在一定条件下来制取,其反应原理为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)ΔH=+203kJ•mol-1。在容积为3L的恒容密闭容器中通入3molCH4和3mol水蒸气,在一定条件下发生上述反应。达到平衡后,测得H2的体积分数与温度及压强的关系如图所示。

比较p1与p2的相对大小:p1
(4)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。

①图中b极要连接电源的
②
 放电的电极反应式为
放电的电极反应式为
您最近一年使用:0次
名校
6 . 低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是一个重要研究方向, 既可变废为宝,又可减少碳的排放。工业上可用CO2和H2制备被誉为“21世纪的清洁燃料”二甲醚(CH3OCH3):
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1
副反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
(1)已知:①CO(g)+2H2(g) CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) H= -41.0kJ/mol
CO2(g)+H2(g) H= -41.0kJ/mol
则主反应I的ΔH1=______ 。
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1∶3投料进行反应,测得不同时间段部分物质的浓度如下表:
①10-20min内,CH3OCH3的平均反应速率v(CH3OCH3)=_______ 。
②根据以上数据计算主反应I的平衡常数K=______ (列式,代入数据,不计算结果)。
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是_______ 。
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是_______ 。
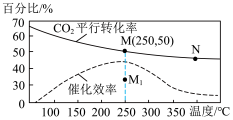
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
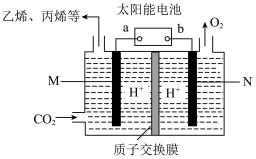
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的_______ 极,写M极上生成丙烯的电极反应式为_________ 。
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1副反应II:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2(1)已知:①CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) H= -41.0kJ/mol
CO2(g)+H2(g) H= -41.0kJ/mol则主反应I的ΔH1=
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1∶3投料进行反应,测得不同时间段部分物质的浓度如下表:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| H2 | 1.00mol/L | 0.68 mol/L | 0.40 mol/L | 0.30 mol/L | 0.30 mol/L |
| CH3OCH3 | 0 mol/L | 0.05 mol/L | 0.08 mol/L | 0.10 mol/L | 0.10 mol/L |
①10-20min内,CH3OCH3的平均反应速率v(CH3OCH3)=
②根据以上数据计算主反应I的平衡常数K=
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的

您最近一年使用:0次
2020-04-01更新
|
271次组卷
|
4卷引用:广东省中山市2019-2020学年高三上学期期末统考化学试题
广东省中山市2019-2020学年高三上学期期末统考化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(七)天津地区2021届高三上学期期中考试模拟测化学试题陕西省西安中学2022届高三下学期第五次模拟考试理科综合化学试题
7 . 《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加 德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是

零价铁活化过硫酸钠去除废水中As(V)的机制模型

零价铁活化过硫酸钠去除废水中As(V)的机制模型
| A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键 |
B.若56g Fe参加反应,共有NA个 被还原 被还原 |
| C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为1×10-10mol·L-1 |
| D.pH越小,越有利于去除废水中的正五价砷 |
您最近一年使用:0次
2020-01-04更新
|
287次组卷
|
3卷引用:广东省广州市三校联考2020-2021学年高二上学期期末考试化学试题
解题方法
8 . 一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g)⇌CH3OH(g) △H<0
① 该反应的平衡常数表达式为____________ 。
② 若容器容积不变,下列措施可增加甲醇产率的是___________ 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:① CO(g)+2H2(g)⇌CH3OH(g) △H1 =-90.7 kJ·mol-1
② 2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
③ CO(g)+H2O(g)⇌CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
则 3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的 △H =_______ kJ·mol-1
(3)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴 (CoSO4)混合溶液,插上两根惰性电极,通电,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:

① 检验电解时产生的CO2气体,井穴板穴孔内应盛放___________ 溶液。
② 写出净化甲醇的离子方程式______________________ 。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g)⇌CH3OH(g) △H<0
① 该反应的平衡常数表达式为
② 若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:① CO(g)+2H2(g)⇌CH3OH(g) △H1 =-90.7 kJ·mol-1
② 2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
③ CO(g)+H2O(g)⇌CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
则 3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的 △H =
(3)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴 (CoSO4)混合溶液,插上两根惰性电极,通电,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:

① 检验电解时产生的CO2气体,井穴板穴孔内应盛放
② 写出净化甲醇的离子方程式
您最近一年使用:0次
9 . 以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l) CuOH(s)+Cl-(aq)+H+(aq)。
CuOH(s)+Cl-(aq)+H+(aq)。
该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____________ 。
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。

①阳极(反应②)的电极反应式为________________________________ 。
②电解一段时间后,电解液补充一定量的__________ 可完全恢复成原电解质溶液(填化学式)。
③溶液中③、④二步总反应的离子方程式为____________________________________ 。
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g) CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。

①该反应的ΔH_____ 0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是__________ ;
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为______ (保留三位有效数字)。起始时,乙容器中c(H2)=0.40 mol·L-1,c(CO)=0.20 mol·L-1,T1℃下反应达到平衡,CO的平衡转化率______ (填字母)。
A.大于40% B.小于40% C.等于40% D.等于80%
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)
 CuOH(s)+Cl-(aq)+H+(aq)。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。

①阳极(反应②)的电极反应式为
②电解一段时间后,电解液补充一定量的
③溶液中③、④二步总反应的离子方程式为
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)
 CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
①该反应的ΔH
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为
A.大于40% B.小于40% C.等于40% D.等于80%
您最近一年使用:0次
10 . 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________ H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________ (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
标注。
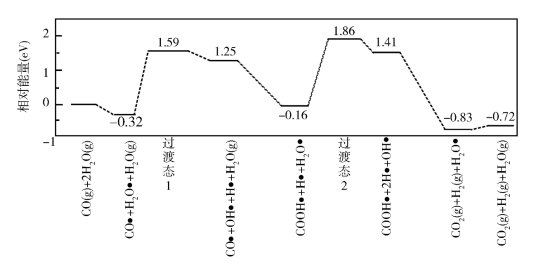
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_______________________ 。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
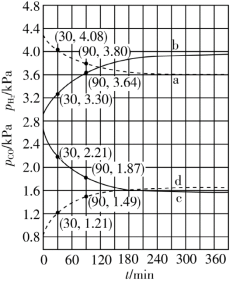
计算曲线a的反应在30~90 min内的平均速率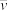 (a)=
(a)=___________ kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________ 、___________ 。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________ 、___________ 。
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用
 标注。
标注。
可知水煤气变换的ΔH
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。

计算曲线a的反应在30~90 min内的平均速率
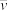 (a)=
(a)=
您最近一年使用:0次
2019-06-09更新
|
19228次组卷
|
20卷引用:2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷
2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题(已下线)专题7.1 化学反应速率(讲)-《2020年高考一轮复习讲练测》(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题专题2.2 化学反应速率和化学平衡(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2章 综合检测高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记江苏省盱眙中学2021-2022学年高二上学期第三次学情调研化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题17 原理综合题(已下线)T28-原理综合题



