名校
1 . A和B转化为C的催化反应历程示意图如下。下列说法不正确的是


| A.催化剂在反应前后保持化学性质不变 |
| B.生成C总反应的原子利用率为100% |
| C.①→②的过程吸收能量 |
| D.C的水溶液呈弱酸性 |
您最近一年使用:0次
2019-02-14更新
|
450次组卷
|
7卷引用:福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题
福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高二上学期期末考试化学试题【市级联考】福建省泉州市2019届高三上学期单科质量检查化学试题(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)福建省霞浦第一中学2018-2019学年高二下学期第一次月考化学试题(B卷)河北省衡水市第十四中学2020-2021学年高二下学期摸底考试化学试题
名校
2 . 工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
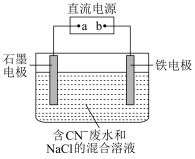
①CN--2e-+2OH-=CNO-+H2O
②2Cl--2e-=Cl2↑
③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO +4H2O
+4H2O
下列说法正确的是

①CN--2e-+2OH-=CNO-+H2O
②2Cl--2e-=Cl2↑
③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO
 +4H2O
+4H2O下列说法正确的是
| A.铁电极上发生的反应为Fe-2e-=Fe2+ |
| B.通电过程中溶液pH不断增大 |
| C.除去1 mol CN-,外电路至少需转移5 mol电子 |
| D.为了使电解池连续工作,需要不断补充NaCl |
您最近一年使用:0次
2019-01-09更新
|
1824次组卷
|
17卷引用:山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高二上学期期末考试化学试题
山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高二上学期期末考试化学试题2015届福建省厦门市普通高中高三质量检查理综化学试卷2016届广东省揭阳一中、金山中学高三下第一次联考化学试卷内蒙古赤峰市宁城县2020届高三10月月考化学试题(已下线)江苏省海安高级中学2019届高三12月月考化学试题江苏省启东中学2020-2021学年高二上学期第二次月考化学试题甘肃省天水市一中2021届高三上学期第三学段考试化学试题湖南省雅礼中学2020-2021学年高二上学期期中考试化学试题山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题江苏省镇江中学2020-2021学年高二上学期期末考试化学试题江苏省常州市新桥高级中学2021-2022学年高二上学期期末质量检测化学试题江苏省扬州市江都区大桥高级中学2020-2021学年高二下学期学情检测(二)化学试题江苏省高邮市2021-2022学年高二上学期期中学情调研化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题江苏省盱眙中学2021-2022学年高二上学期第三次学情调研化学试题(已下线)2022年湖北省高考真题变式题11-15江苏省苏州第一中学校2023-2024学年高二上学期10月月考化学试题
解题方法
3 . 从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________ (填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________ 。

(3)从断键和成键的角度分析上述反应中能量的变化。
请填写下表:
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______ 极发生_______ 反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______ L。
(1)为了加快正反应速率,可以采取的措施有
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是

(3)从断键和成键的角度分析上述反应中能量的变化。
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
请填写下表:
| 化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
| 拆开化学键 | 2molH2化学键 | ||
| 1molO2化学键 | |||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在
您最近一年使用:0次
2018-07-27更新
|
198次组卷
|
3卷引用:山西省柳林县2019-2020学年高一下学期期末教学质量检测化学试题
4 . 利用钛白粉厂的废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH:
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为__________
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_____ (填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________ 。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式: 2[Fe(NH3)2]2+ +________ +4H2O +H2O2 =_______ + 4NH3·H2O 。
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,1mol S2O82-过氧键的数目为___________ 。
②电解时,铁电极连接电源的___________ 极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为___________ ,阳极的电极反应式为______________________ 。

已知:i.部分离子完全生成氢氧化物沉淀的pH:
| 金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
| 沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式: 2[Fe(NH3)2]2+ +
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,1mol S2O82-过氧键的数目为
②电解时,铁电极连接电源的
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为
您最近一年使用:0次
2018-05-28更新
|
275次组卷
|
3卷引用:山西省长治市城区第二中学校2018-2019学年高二上学期期末考试化学试题
名校
5 . 研究NO2、NO、CO、NO2-等污染物的处理,对环境保护有重要的意义。
(1)①NO2(g)+CO(g) CO2(g)+NO(g) △H1=-234.00kJ·mol-1
CO2(g)+NO(g) △H1=-234.00kJ·mol-1
②1/2N2(g)+1/2O2(g) NO(g) △H2=-89.75 kJ·mol-1
NO(g) △H2=-89.75 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) △H3=-112.30kJ·mol-1
2NO2(g) △H3=-112.30kJ·mol-1
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为__________________ 。
(2)某温度下,向10L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生反应:2NO2(g)+ 4CO(g) N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
①0~10min内,CO的平均反应速率v(CO)=___________ ;
②若容器中观察到____________________________ ,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为
________ ;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡________ (填“右移”或“左移”或“不移动”)。
(3)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是________ [用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。


②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因_____________________________________ (假设该温度范围内催化剂的催化效率相同)。
(4)有人设想在含有NO2-的酸性污水中加入填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_________________________________ 。
(1)①NO2(g)+CO(g)
 CO2(g)+NO(g) △H1=-234.00kJ·mol-1
CO2(g)+NO(g) △H1=-234.00kJ·mol-1②1/2N2(g)+1/2O2(g)
 NO(g) △H2=-89.75 kJ·mol-1
NO(g) △H2=-89.75 kJ·mol-1③2NO(g)+O2(g)
 2NO2(g) △H3=-112.30kJ·mol-1
2NO2(g) △H3=-112.30kJ·mol-1若NO2气体和CO气体反应生成无污染气体,其热化学方程式为
(2)某温度下,向10L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生反应:2NO2(g)+ 4CO(g)
 N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30①0~10min内,CO的平均反应速率v(CO)=
②若容器中观察到
③为增大污染物处理效率,起始最佳投料比为

④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡
(3)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是


②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因
(4)有人设想在含有NO2-的酸性污水中加入填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用
您最近一年使用:0次
2018-05-16更新
|
895次组卷
|
5卷引用:【市级联考】山西省吕梁市2019届高三上学期期末考试模拟化学试题
名校
6 . 硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4=H++HSO ,
, 。请回答下列有关问题:
。请回答下列有关问题:
(1)Na2SO4溶液呈_______ (填“弱酸性”“中性”或“弱碱性”),其理由是(用离子方程式表示)_____________ 。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为______________________________ 。
(3)在0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是____ (填字母)
A.c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO4)
)+c(H2SO4)
B.c(OH-)=c(HSO )+c(H+)
)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO )+2c(SO
)+2c(SO )
)
D.c(Na+)=2c(SO )+2c(HSO
)+2c(HSO )
)
(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO )=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO
)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO )
)___ (填“<”“>”或“=”)0.029 mol/L。
(5)若25℃时,0.10mol/ LH2SO4溶液的pH=-lg0.11,则0.10mol/L H2SO4溶液中c(SO )=
)=____ mol/L。
 ,
, 。请回答下列有关问题:
。请回答下列有关问题:(1)Na2SO4溶液呈
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
(3)在0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是
A.c(Na+)=c(SO
 )+c(HSO
)+c(HSO )+c(H2SO4)
)+c(H2SO4)B.c(OH-)=c(HSO
 )+c(H+)
)+c(H+)C.c(Na+)+c(H+)=c(OH-)+c(HSO
 )+2c(SO
)+2c(SO )
)D.c(Na+)=2c(SO
 )+2c(HSO
)+2c(HSO )
)(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO
 )=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO
)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO )
)(5)若25℃时,0.10mol/ LH2SO4溶液的pH=-lg0.11,则0.10mol/L H2SO4溶液中c(SO
 )=
)=
您最近一年使用:0次
名校
7 . 工业上利用反应2C+SiO2 Si+2CO↑冶炼硅单质,有关叙述错误的是( )
Si+2CO↑冶炼硅单质,有关叙述错误的是( )
 Si+2CO↑冶炼硅单质,有关叙述错误的是( )
Si+2CO↑冶炼硅单质,有关叙述错误的是( )| A.每当固体质量减轻5.6g时,生成2.8g Si |
| B.氧化剂和还原剂的物质的量之比为1:2 |
| C.硅单质在常温下不与任何酸、碱反应 |
| D.单质硅与单质碳均具有一定的还原性 |
您最近一年使用:0次
名校
8 . 对于反应;2NO(g)+2CO(g) 2CO2(g)+N2 (g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1 时已达到平衡状态的是
2CO2(g)+N2 (g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1 时已达到平衡状态的是
 2CO2(g)+N2 (g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1 时已达到平衡状态的是
2CO2(g)+N2 (g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1 时已达到平衡状态的是A.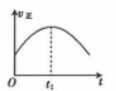 | B.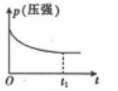 | C.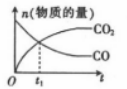 | D.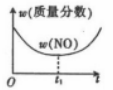 |
您最近一年使用:0次
2017-08-19更新
|
745次组卷
|
8卷引用:山西省临汾第一中学等五校2017-2018学年高二上学期期末联考化学试题
9 . 硫酸是一种重要的化工产品,2SO2+O2 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在 |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
您最近一年使用:0次



