解题方法
1 . 二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。

(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
请回答下列问题:
①该反应的ΔH___ (填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)=___ 。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是___ 。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为____ 。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为___ 点。
(3)已知反应S4(g)+4Cl2(g)=4SCl2(g)的ΔH=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为___ kJ。
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2,Ka2=1.02×10-7,向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H2SO3),则c(H+)
)>c(H2SO3),则c(H+)___ c(OH-)(填“大于”、“小于”或“等于”,下同)
②当V=amL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO )+c(HSO
)+c(HSO );当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO
);当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO3);则a
)+c(H2SO3);则a___ b。
(5)以SOCl2溶解四氯铝锂的溶液作为电解质溶液,用金属锂和石墨作电极材料,可组成一种常见的锂电池,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,请写出该电池正极的电极反应方程式___ 。
 2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| Ⅰ | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| Ⅱ | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①该反应的ΔH
②I反应开始至达到平衡时,v(SOCl2)=
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为
②当升高到某一温度时,反应重新达到平衡,A点可能变化为
(3)已知反应S4(g)+4Cl2(g)=4SCl2(g)的ΔH=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2,Ka2=1.02×10-7,向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO
 )>c(SO
)>c(SO )>c(H2SO3),则c(H+)
)>c(H2SO3),则c(H+)②当V=amL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO
 )+c(HSO
)+c(HSO );当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO
);当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO3);则a
)+c(H2SO3);则a(5)以SOCl2溶解四氯铝锂的溶液作为电解质溶液,用金属锂和石墨作电极材料,可组成一种常见的锂电池,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,请写出该电池正极的电极反应方程式
您最近一年使用:0次
2 . 合成氨反应是目前最有效工业固氮的方法,解决数亿人口生存问题。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

写出合成氨的热化学方程式:______________ ;该反应历程中最大能垒对应的化学方程式为:_______________________ 。
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=_____ kJ·mol-1;使用催化剂之后,正反应的活化能为________ kJ·mol-1。

(3)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是____ (填“A”“B”或“C”),理由是_______________ 。

(4)一定温度下,将l mol N2和3 mol H2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=____ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(5)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:

①固体氧化物电池工作的电解质,O2-移向__________ (填字母)。
A 电极a B 电极b
②该电池工作时,电极a上发生的电极反应为______________ 。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

写出合成氨的热化学方程式:
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=

(3)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是

(4)一定温度下,将l mol N2和3 mol H2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=
(5)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:

①固体氧化物电池工作的电解质,O2-移向
A 电极a B 电极b
②该电池工作时,电极a上发生的电极反应为
您最近一年使用:0次
2020-12-02更新
|
289次组卷
|
2卷引用:山西省运城市2021届高三上学期期中考试化学试题
3 . (1)碳的氧化物可用来制备碳酰肼[ ,其中碳元素为
,其中碳元素为 价].加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳.该反应的化学方程式为
价].加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳.该反应的化学方程式为________ .
(2)控制城市空气污染源的方法可以有_________ (多选)
A.开发新能源B.使用电动车C.植树造林D.戴上呼吸面具
(3) 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如
有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如 ),经以下反应实现:
),经以下反应实现: ,则生成物A的化学式为
,则生成物A的化学式为________ .
(4)火法炼铅的废气中含低浓度 ,可将废气通入过量氨水中进行处理,反应的离子方程式为
,可将废气通入过量氨水中进行处理,反应的离子方程式为______ .
(5)取 某钛液,加铝粉,使其发生反应
某钛液,加铝粉,使其发生反应 (未配平),反应消耗铝
(未配平),反应消耗铝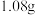 ,则该钛液中
,则该钛液中 的物质的量浓度为
的物质的量浓度为__________ .
(6)工业上利用纳米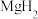 和
和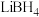 组成的体系储放氢(如图所示).写出放氢过程中发生反应的化学方程式:
组成的体系储放氢(如图所示).写出放氢过程中发生反应的化学方程式:_____________ .

(7)工业上可以采用热还原法制备金属镁(沸点107℃,熔点648.8℃).将碱式碳酸镁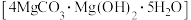 和焦炭按一定比例混合,放入真空管式炉中先升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体).
和焦炭按一定比例混合,放入真空管式炉中先升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体).

①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是__________ .
②碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:_________ .
 ,其中碳元素为
,其中碳元素为 价].加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳.该反应的化学方程式为
价].加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳.该反应的化学方程式为(2)控制城市空气污染源的方法可以有
A.开发新能源B.使用电动车C.植树造林D.戴上呼吸面具
(3)
 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如
有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如 ),经以下反应实现:
),经以下反应实现: ,则生成物A的化学式为
,则生成物A的化学式为(4)火法炼铅的废气中含低浓度
 ,可将废气通入过量氨水中进行处理,反应的离子方程式为
,可将废气通入过量氨水中进行处理,反应的离子方程式为(5)取
 某钛液,加铝粉,使其发生反应
某钛液,加铝粉,使其发生反应 (未配平),反应消耗铝
(未配平),反应消耗铝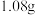 ,则该钛液中
,则该钛液中 的物质的量浓度为
的物质的量浓度为(6)工业上利用纳米
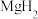 和
和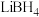 组成的体系储放氢(如图所示).写出放氢过程中发生反应的化学方程式:
组成的体系储放氢(如图所示).写出放氢过程中发生反应的化学方程式:
(7)工业上可以采用热还原法制备金属镁(沸点107℃,熔点648.8℃).将碱式碳酸镁
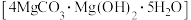 和焦炭按一定比例混合,放入真空管式炉中先升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体).
和焦炭按一定比例混合,放入真空管式炉中先升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体).
①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是
②碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:
您最近一年使用:0次
名校
4 . 我国学者研究了均相 NO- CO 的反应历程,反应路径中每一阶段内各驻点的能最均为相对于此阶段内反应物能量的能量之差,下列说法正确的是
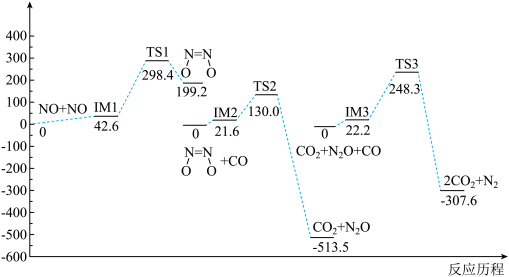

A.2NO(g)+ 2CO(g)  N2(g) +2CO2(g) ΔH>O N2(g) +2CO2(g) ΔH>O |
| B.均相NO—CO反应经历了三个过渡态和六个中间体 |
| C.整个反应分为三个基元反应阶段,总反应速率由第一阶段反应决定 |
D.NO二聚体(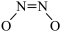 )比N2O分子更难与CO发生反应 )比N2O分子更难与CO发生反应 |
您最近一年使用:0次
5 . 煤和天然气都是重要的化石资源,在工业生产中用途广泛。
(1)燃煤时往往在煤中添加石灰石,目的是_______ ,达到该目的时发生反应的化学方程式为____________ 。
(2)煤的综合利用包括________ (将煤隔绝空气加强热)、煤的气化和液化。煤的气化是将其转化为可燃性气体的过程,主要发生的反应的化学方程式为_________ 。
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S_____ (填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为_____ 。
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。
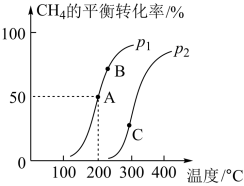
①200 °C时,该反应的平衡常数K=__________ 。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是_________ 。
③压强:p1___________ (填“>”“<”或“=”)p2。
(1)燃煤时往往在煤中添加石灰石,目的是
(2)煤的综合利用包括
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
| 温度/°C | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。

①200 °C时,该反应的平衡常数K=
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③压强:p1
您最近一年使用:0次
名校
解题方法
6 . 开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。

回答下列问题:
(1)反应②的化学方程式为____________________________________________ 。
(2)反应④的离子方程式为____________________________________________ 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是________  (填字母代号)。
(填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________ 。
③已知:反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
求:Ⅱ反应的逆反应方程式CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=________ (用K1和K2表示),且由表可知,反应CO2(g)+H2(g) CO(g)+H2O(g)是
CO(g)+H2O(g)是___________ 反应(填“吸热”或“放热”)。
(4)我国科研人员也提出了由CO2和CH4转化为高附加值产品和CH3COOH的催化反应历程,该历程示意图如下。下列说法不正确的是________

A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率

回答下列问题:
(1)反应②的化学方程式为
(2)反应④的离子方程式为
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是
 (填字母代号)。
(填字母代号)。a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为
③已知:反应Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:| 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
求:Ⅱ反应的逆反应方程式CO2(g)+H2(g)
 CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K= CO(g)+H2O(g)是
CO(g)+H2O(g)是(4)我国科研人员也提出了由CO2和CH4转化为高附加值产品和CH3COOH的催化反应历程,该历程示意图如下。下列说法不正确的是

A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
您最近一年使用:0次
名校
解题方法
7 . 联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的结构式为_____________ ,其中氮的化合价为____________ 。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________ 。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=__________ ,联氨和N2O4可作为火箭推进剂的主要原因为__________ 。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的电离方程式依次为______ ,________ 。第一步电离的平衡常数值为________ (已知:N2H4+H+⇌N2H 的K=8.7×107;KW=1.0×10-14)。
的K=8.7×107;KW=1.0×10-14)。
(5)联氨是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,处理时发生反应的化学方程式为________ 。
(1)联氨分子的结构式为
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的电离方程式依次为
 的K=8.7×107;KW=1.0×10-14)。
的K=8.7×107;KW=1.0×10-14)。(5)联氨是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,处理时发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有________________ (任写两种)。
(2)气体X是____ ,滤渣1溶于一定浓度硫酸溶液后,加热到70~80℃可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5)n]m,则该物质中铁元素的化合价为________ 。溶液采用的加热方式为________ ,控制温度70~80℃的原因是________________ 。若溶液的pH偏小,将导致聚铁中铁的质量分数________ (填“偏高”、“偏低”或“无影响”)。
(3)加入H2O2的目的是________________ 。若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为________________ 。
(4)“一系列操作”主要包括加入足量盐酸,然后经过________________ 、过滤、洗涤,即得到氯化镁晶体。

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有
(2)气体X是
(3)加入H2O2的目的是
(4)“一系列操作”主要包括加入足量盐酸,然后经过
您最近一年使用:0次
2020-09-25更新
|
1568次组卷
|
5卷引用:山西省实验中学2021届高三9月月考化学试题
山西省实验中学2021届高三9月月考化学试题山西省实验中学2020-2021学年高三上学期第一次月考化学试题甘肃省白银市会宁县第一中学2020-2021学年高二上学期第二次月考化学试题江西省赣州市赣县第三中学2021-2022学年高二下学期5月月考化学试题(已下线)模拟卷04-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)
名校
解题方法
9 . 已知反应S2O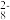 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )

①2Fe3+(aq)+2I-(aq) I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)
②2Fe2+(aq)+S2O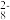 (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)
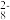 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
①2Fe3+(aq)+2I-(aq)
 I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O
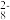 (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)| A.Fe3+是该反应的催化剂,加入Fe3+后降低了该反应的活化能 |
| B.反应①比反应②所需活化能大 |
| C.向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深 |
| D.该反应可设计成原电池 |
您最近一年使用:0次
2020-09-25更新
|
1721次组卷
|
14卷引用:山西省大同市2021届高三上学期学情调研测试化学试题
山西省大同市2021届高三上学期学情调研测试化学试题辽宁省六校协作体2021届高三第一次联考化学试题江西省赣州市会昌县七校2021届高三联合9月月考化学试题辽宁省开原市中固镇第二中学2021届高三上学期9月月考化学试题内蒙古自治区赤峰二中2020-2021学年高二上学期第一次月考化学试题江西省红色七校(分宜中学、会昌中学、莲花中学、南城一中、任弼时中学、瑞金一中、遂川中学)2021届高三上学期第一次联考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题江苏省苏州市姑苏区苏州中学2020-2021学年高二下学期期中考试化学试题江西省景德镇一中2020-2021学年高一下学期期中考试化学(1班)试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题
名校
10 . 戴口罩是防控新型冠状病毒的重要手段,口罩生产的主要原料聚丙烯由丙烯聚合而来。丙烷脱氢是丙烯工业生产的重要途径。反应的热化学方程式为C3H8(g) C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:
(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是___ 。
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是___ 、___ 。
②丙烷脱氢制丙烯反应在___ (选“高温”或“低温”)时更加容易自发进行。
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是___ 。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为___ 。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___ 。
 C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是
②丙烷脱氢制丙烯反应在
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近一年使用:0次
2020-08-28更新
|
534次组卷
|
5卷引用:山西省大同市第一中学2021届高三上学期期中质量检测化学试题
山西省大同市第一中学2021届高三上学期期中质量检测化学试题河南省洛阳市2020届高三第三次统一考试理综化学试题(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编河南省洛阳市2020届高三三模化学试卷江西省吉安一中2021-2022学年高二上学期第一次段考化学试题



