1 . 合成氨反应是目前最有效工业固氮的方法,解决数亿人口生存问题。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

写出合成氨的热化学方程式:______________ ;该反应历程中最大能垒对应的化学方程式为:_______________________ 。
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=_____ kJ·mol-1;使用催化剂之后,正反应的活化能为________ kJ·mol-1。

(3)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是____ (填“A”“B”或“C”),理由是_______________ 。

(4)一定温度下,将l mol N2和3 mol H2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=____ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(5)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:

①固体氧化物电池工作的电解质,O2-移向__________ (填字母)。
A 电极a B 电极b
②该电池工作时,电极a上发生的电极反应为______________ 。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

写出合成氨的热化学方程式:
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=

(3)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是

(4)一定温度下,将l mol N2和3 mol H2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=
(5)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:

①固体氧化物电池工作的电解质,O2-移向
A 电极a B 电极b
②该电池工作时,电极a上发生的电极反应为
您最近一年使用:0次
2020-12-02更新
|
292次组卷
|
2卷引用:山西省运城市2021届高三上学期期中考试化学试题
2 . 煤和天然气都是重要的化石资源,在工业生产中用途广泛。
(1)燃煤时往往在煤中添加石灰石,目的是_______ ,达到该目的时发生反应的化学方程式为____________ 。
(2)煤的综合利用包括________ (将煤隔绝空气加强热)、煤的气化和液化。煤的气化是将其转化为可燃性气体的过程,主要发生的反应的化学方程式为_________ 。
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S_____ (填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为_____ 。
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。
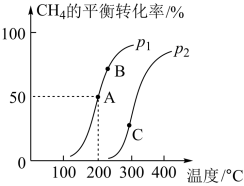
①200 °C时,该反应的平衡常数K=__________ 。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是_________ 。
③压强:p1___________ (填“>”“<”或“=”)p2。
(1)燃煤时往往在煤中添加石灰石,目的是
(2)煤的综合利用包括
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
| 温度/°C | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。

①200 °C时,该反应的平衡常数K=
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③压强:p1
您最近一年使用:0次
名校
解题方法
3 . 联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的结构式为_____________ ,其中氮的化合价为____________ 。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________ 。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=__________ ,联氨和N2O4可作为火箭推进剂的主要原因为__________ 。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的电离方程式依次为______ ,________ 。第一步电离的平衡常数值为________ (已知:N2H4+H+⇌N2H 的K=8.7×107;KW=1.0×10-14)。
的K=8.7×107;KW=1.0×10-14)。
(5)联氨是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,处理时发生反应的化学方程式为________ 。
(1)联氨分子的结构式为
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的电离方程式依次为
 的K=8.7×107;KW=1.0×10-14)。
的K=8.7×107;KW=1.0×10-14)。(5)联氨是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,处理时发生反应的化学方程式为
您最近一年使用:0次
解题方法
4 . 磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25°C时,磷酸和碳酸的电离常数如下表所示。
向Na2CO3溶液中滴加少量H3PO4溶液,反应的离子方程式为__ 。
(2)已知:
I.CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ∆H= -271kJ·mol-1
II.5CaO(s)+3H3PO4(l)+HF(g)=Ca3(PO4)3F(s)+5H2O(l) ∆H=-937 kJ·mol-1
回答下列问题:
①工业上用Ca3(PO4)3F和硫酸反应制备磷酸的热化学方程式为__ 。
②一定条件下,在密闭容器中只发生反应II,达到平衡后缩小容器容积,HF的平衡转化率__ (填“增大”“减小”或“不变”,下同);HF的平衡浓度__ 。
(3)工业上用磷尾矿制备Ca3(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)=CO2(g)+H2(g) ∆H。
①一定温度下,向10L密闭容器中充入0.5molCO和lmolH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L-1·min-1。则CO的平衡转化率a=__ ,该反应的平衡常数K=__ 。
②在压强不变的密闭容器中发生上述反应,设起始的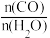 =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H__ 0(填“>”“<”或“=”,下同)。a_ 1,理由为__ 。

(1)已知:25°C时,磷酸和碳酸的电离常数如下表所示。
物质 | H3PO4 | H2CO3 |
电离常数 | Ka1=7.1×10-3 Ka2= 6.3×10-8 Ka3= 4.2×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
(2)已知:
I.CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ∆H= -271kJ·mol-1
II.5CaO(s)+3H3PO4(l)+HF(g)=Ca3(PO4)3F(s)+5H2O(l) ∆H=-937 kJ·mol-1
回答下列问题:
①工业上用Ca3(PO4)3F和硫酸反应制备磷酸的热化学方程式为
②一定条件下,在密闭容器中只发生反应II,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备Ca3(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)=CO2(g)+H2(g) ∆H。
①一定温度下,向10L密闭容器中充入0.5molCO和lmolH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L-1·min-1。则CO的平衡转化率a=
②在压强不变的密闭容器中发生上述反应,设起始的
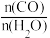 =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H
您最近一年使用:0次
5 . 下列图示与对应的叙述不相符合的是
A.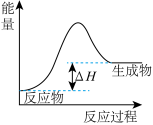 表示燃料燃烧反应的能量变化 表示燃料燃烧反应的能量变化 |
B.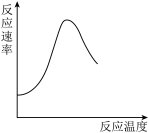 表示酶催化反应的反应速率随反应温度的变化 表示酶催化反应的反应速率随反应温度的变化 |
C.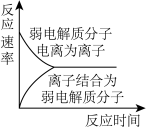 表示弱电解质在水中建立电离平衡的过程 表示弱电解质在水中建立电离平衡的过程 |
D.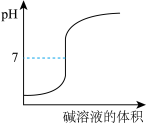 表示强碱滴定强酸的滴定曲线 表示强碱滴定强酸的滴定曲线 |
您最近一年使用:0次
2019-01-30更新
|
1417次组卷
|
46卷引用:山西省运城市新绛中学2021届高三上学期8月月考化学试题
山西省运城市新绛中学2021届高三上学期8月月考化学试题2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2017届河北省衡水中学高三上学期摸底考试化学试卷2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届河南省郑州一中高三上期中化学试卷2017届宁夏石嘴山三中高三上期中化学试卷2016-2017学年天津市部分区高二上学期期末化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题云南省玉溪市民族中学2017-2018学年高二上学期期中考试化学试卷河北省衡水市安平中学2017-2018学年高二上学期期中考试化学试题鄱阳一中2017-2018学年度上学期高二年级第二次检测化学试卷江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题广东省惠州市2018届高三第三次调研考理科综合化学试题1山东省德州市2017-2018学年高二上学期期末考试化学试题广东省惠州市2018届高三第三次调研考理科综合化学试题2广东省普宁市华美实验学校2017-2018学年高二下学期第一次月考化学试题福建省晋江市季延中学2017-2018学年高二下学期期末考试化学试题四川省内江铁路中学2019届高三上学期入学考试化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题(已下线)考点11 化学反应速率——备战2019年浙江新高考化学考点2016年全国普通高等学校招生统一考试化学(江苏卷参考版)【全国百强校】江苏省启东中学2018-2019学年高一(创新班)下学期3月月考化学试题江苏省苏州市第五中学2018-2019学年高二下学期期中考试化学试题广西桂林市中山中学2018-2019学年高二下学期期中考试化学试题新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题贵州省都匀第一中学2019-2020学年高二上学期期中考试化学试题安徽省阜阳市颍上二中2019-2020学年高二上学期第二次段考化学试题福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题湖北省宜昌市长阳土家族自治县第一高级中学2020-2021学年高二上学期期中考试化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题河北省衡水市武强中学2020-2021学年高二上学期第三次月考化学试题辽宁省营口市2020-2021学年高二上学期期末考试化学试题湖北省宜昌市夷陵中学2021-2022学年高二下学期诊断性检测(二)化学试题江苏省徐州市睢宁县第一中学2021-2022学年高二下学期第一次月考化学试题福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题浙江省北斗联盟2022-2023学年高二上学期期中联考化学试题内蒙古莫力达瓦旗尼尔基第一中学2021-2022学年高三上学期期末考试化学试题山东省德州市德州耀华学校2021-2022学年高二上学期第三次质量调研12月考化学试题浙江省绍兴市柯桥区2022-2023学年高二上学期期末教学质量调测化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
6 . SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。

(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为________ 极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为________________________________________________________________________ 。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为________________________________________________________________________ 。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。

①电池总反应为________________________________________________________________________ 。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为______ L。电解后溶液体积为2 L,溶液的pH约为________ 。

(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。

①电池总反应为
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为
您最近一年使用:0次
名校
解题方法
7 . 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为________ mol·L-1·min-1。
(2)由表中数据判断ΔH1______ (填“>”“<”或“=”)0;反应CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3=
CO(g)+H2O(g) ΔH3=_________ (用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是______ (填序号)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=__________________ ;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡_______ (填“正向”“逆向”或“不”)移动,平衡常数KⅡ__________ (填“变大”“变小”或“不变”)。
(5)比较这两种合成甲醇的方法,原子利用率较高的是______ (填“Ⅰ”或“Ⅱ”)。
反应Ⅰ:CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| KⅠ | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为
(2)由表中数据判断ΔH1
 CO(g)+H2O(g) ΔH3=
CO(g)+H2O(g) ΔH3=(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=
(5)比较这两种合成甲醇的方法,原子利用率较高的是
您最近一年使用:0次
2018-04-22更新
|
694次组卷
|
10卷引用:四川省宜宾市南溪一中2017-2018学年高二下学期第一次月考化学试题
四川省宜宾市南溪一中2017-2018学年高二下学期第一次月考化学试题(已下线)2019年9月29日《每日一题》选修4—— 每周一测(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》山东省临沂市费县地区化学2020-2021学年高二上学期9月月考化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过素养 学科素养拓展训练河南省正阳县高级中学2020-2021学年高二上学期第二次素质检测化学试题山西省运城市芮城中学2021-2022学年高二上学期阶段性月考化学试题江苏省吴江汾湖高级中学2020-2021学年高二下学期阶段性教学质量检测化学试题云南省曲靖市马龙二中2020-2021学年高二5月月考化学试题黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题
8 . 氮的氧化物是主要的空气污染物,目前消除氯氧化物污染的方法有多种。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:________
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=___ mol,NO2的转化率a1=_________ .其它条件不变,反应在恒压条件下进行,平衡时NO2的转化率a2____ a1(填“大于” 小于”或“ 等于” )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据 是_________
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为_______ (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是________ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g) N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
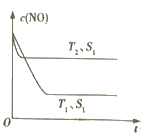
①该反应的ΔH____ 0(填“>”或“<”)。
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。____
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下| 时间 浓度(mol/L) 物质 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据 是
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的ΔH
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
您最近一年使用:0次
9 . 甲醇的燃点低,很容易着火,是发展前景很好的一种液体燃料。
(1)已知甲醇的燃烧热为726.5kJ/mol,则甲醇燃烧的热化学方程式为_________ .
(2)利用合成气主要成分为CO和H2)在催化剂的作用下合成甲醇,已知反应中有关物质的化学键键能数据如下表所示:
则: CO(g)+2H2(g)⇌CH3OH(g)△H=_________ kJ•mol-1,每消耗标准状况下8.96LCO时转移电子的物质的量是________ .
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是月前研究较多的一类固体氧化物燃料电池工作原理示意图。B极为电池____ 极,B极的电极反应式为____
(1)已知甲醇的燃烧热为726.5kJ/mol,则甲醇燃烧的热化学方程式为
(2)利用合成气主要成分为CO和H2)在催化剂的作用下合成甲醇,已知反应中有关物质的化学键键能数据如下表所示:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则: CO(g)+2H2(g)⇌CH3OH(g)△H=
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是月前研究较多的一类固体氧化物燃料电池工作原理示意图。B极为电池

您最近一年使用:0次
名校
解题方法
10 . 运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g) CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g) CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g) CH3OH(g) ΔH=
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________ (填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1________ p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______ ;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________ (填“增大”、“减小”或“不变”)。
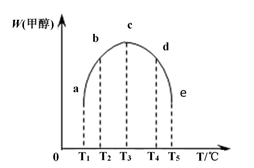
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______ 。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g)
 CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1②CO(g)+1/2O2(g)
 CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1③H2(g)+1/2O2(g)
 H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1则CO(g)+2H2 (g)
 CH3OH(g) ΔH=
CH3OH(g) ΔH=(2)下列措施中能够增大上述合成甲醇反应的反应速率的是
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1
②100 ℃时,该反应的化学平衡常数K=
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是

您最近一年使用:0次
2017-10-11更新
|
104次组卷
|
2卷引用:山西省运城市康杰中学2017-2018学年高二上学期第一次月考化学试题



