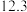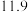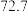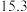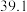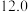解题方法
1 . 研究NOx、SO2等大气污染物的妥善处理对于解决化学污染问题具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收。吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
②NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=bkJ•mol-1
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(ag) ΔH3=ckJ•mol-1
则反应SO2(g)+2NH3•H2O(aq)+ O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=
O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=___ 。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:
2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:
0~10min内,平均反应速率v(O2)=___ mol•L-1•min-1。
(3)NOx的排放主要来自于汽车尾气,有人用活性炭对NO进行吸附,反应为C(s)+2NO(g) N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
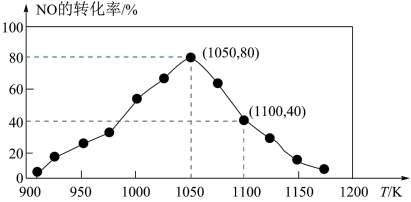
①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因是___ ;在1100K时,CO2的体积分数为___ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___ (已知:气体分压(P分)气体总压(P)×体积分数)
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,只升高温度,k正增大的倍数___ (填“>”,“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =
=___ 。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收。吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
②NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=bkJ•mol-1
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(ag) ΔH3=ckJ•mol-1
则反应SO2(g)+2NH3•H2O(aq)+
 O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=
O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)
 2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:
2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:| 时间/min 浓度/mol▪L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
(3)NOx的排放主要来自于汽车尾气,有人用活性炭对NO进行吸附,反应为C(s)+2NO(g)
 N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因是
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。①达到平衡后,只升高温度,k正增大的倍数
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则
 =
=
您最近半年使用:0次
名校
2 . 碳、氮能形成多种氧化物、氢化物
(1)已知:①2NO(g) N2(g)+O2(g)△H1=-180.5 kJ·mol-1
N2(g)+O2(g)△H1=-180.5 kJ·mol-1
②CO(g)+ O2(g)
O2(g) CO2(g)△H2=-283 kJ·mol-1
CO2(g)△H2=-283 kJ·mol-1
则NO与CO反应生成两种无毒气体的热化学方程式为_______ 。
(2)使用高效催化剂可大大减少汽车尾气排放出的NOx含量,某研究所的科研人员探究了T1℃时等质量的三种催化剂对CO还原NO的催化效果(其他条件相同),所得结果如图所示。

①如果不考虑催化剂价格,则使用催化剂_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成CO2的速率大小关系是_______ 。
②若容器容积为2 L,开始时加入0.5 mol NO、0.5 mol CO,在催化剂Ⅰ的作用下达到如图1所示平衡,则反应2NO(g)+2CO(g) N2(g)+2CO2(g)在该温度下的平衡常数K=
N2(g)+2CO2(g)在该温度下的平衡常数K=_______ L·mol-1。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:aA+bB→cC+dD,其速率方程式为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应NO2(g)+CO(g) NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.
NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ._______ =NO3+_______ ;Ⅱ.略,这两个反应中活化能较小的是_______ 。
②某科研小组测得380℃时该反应的c(NO2)、c(CO)与生成CO2的速率[v(CO2)]的关系如下:则该温度下的反应速率常数k=_______ L·mol-1·s-1.
(1)已知:①2NO(g)
 N2(g)+O2(g)△H1=-180.5 kJ·mol-1
N2(g)+O2(g)△H1=-180.5 kJ·mol-1②CO(g)+
 O2(g)
O2(g) CO2(g)△H2=-283 kJ·mol-1
CO2(g)△H2=-283 kJ·mol-1则NO与CO反应生成两种无毒气体的热化学方程式为
(2)使用高效催化剂可大大减少汽车尾气排放出的NOx含量,某研究所的科研人员探究了T1℃时等质量的三种催化剂对CO还原NO的催化效果(其他条件相同),所得结果如图所示。

①如果不考虑催化剂价格,则使用催化剂
②若容器容积为2 L,开始时加入0.5 mol NO、0.5 mol CO,在催化剂Ⅰ的作用下达到如图1所示平衡,则反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)在该温度下的平衡常数K=
N2(g)+2CO2(g)在该温度下的平衡常数K=(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:aA+bB→cC+dD,其速率方程式为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应NO2(g)+CO(g)
 NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.
NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.②某科研小组测得380℃时该反应的c(NO2)、c(CO)与生成CO2的速率[v(CO2)]的关系如下:则该温度下的反应速率常数k=
| c(CO)/(mol·L-1) | 0.025 | 0.05 | 0.025 |
| c(NO2)/(mol·L-1) | 0.04 | 0.04 | 0.12 |
| v(CO2)/(mol·L-1·s-1) | 2.2×10-4 | 4.4×10-4 | 6.6×10-4 |
您最近半年使用:0次
2021-01-01更新
|
355次组卷
|
3卷引用:宁夏银川一中2021届高三第五次月考化学试题
名校
3 . 用硫酸分解磷尾矿[主要成分为Ca5(PO4)3F]可制得中强酸磷酸。已知:25 ℃时,H3PO4的电离平衡常数:K1=7.1×10−3;K2=6.3×10−8;K3=4.2×10−13.请回答:
(1)NaH2PO4溶液中c(HP )
) ___________ c(H3PO4)(填“>”“<”或“=”)。
(2)25 ℃时,H2P (aq)+OH-(aq)
(aq)+OH-(aq)  HP
HP (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=___________ 。
(3)Ca5(PO4)3F(s)+OH-(aq) Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
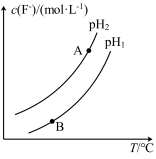
则:pH1___________ pH2(填“>”“<”或“=”,下同);A、B两点的溶液中用F-表示的反应速率υ(A)___________ υ(B)。
(4)下列说法正确的是___________
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中 的值增大
的值增大
D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
(1)NaH2PO4溶液中c(HP
 )
) (2)25 ℃时,H2P
 (aq)+OH-(aq)
(aq)+OH-(aq)  HP
HP (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=(3)Ca5(PO4)3F(s)+OH-(aq)
 Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
则:pH1
(4)下列说法正确的是
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中
 的值增大
的值增大D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
您最近半年使用:0次
2020-12-11更新
|
522次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题
4 . 2019年12月20日,美国总统特朗普签署了2020财政年度国防授权法案,对俄罗斯向欧洲进行天然气输出的“北溪2号”管道项目实施制裁,实施“美国优先发展战略”。天然气 既是一种优质能源,又是一种重要化工原料,甲烷水蒸气催化重整制备高纯氢是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.CH4(g)+H2O(g)⇌CO(g)+3H2(g)∆H=+206.4kJ mol-1
mol-1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H=-44.1kJ mol-1
mol-1
根据上述信息请写出甲烷水蒸气催化重整的热化学反应方程式:_____
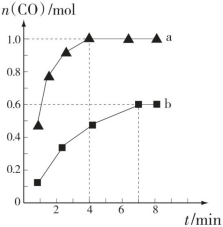
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1mol H2O(g),利用反应Ⅰ制备H2,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2L)。
①恒温,恒容时,能判断反应Ⅰ一定处于化学平衡状态的依据是______ (填写字母序号)。
A.混合气体的压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.混合气体的平均相对分子质量不随时间改变
②a、b两容器的温度______ (填“相同”“不相同”或“不确定”);容器a中CH4从反应开始到恰好平衡时的平均反应速率为______ ,在该温度下反应的化学平衡常数K=_____ 。
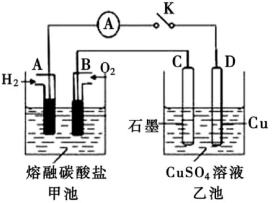
(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中CO2参与电极反应。工作时负极的电极反应为2H2+2CO -4e-=2H2O+2CO2。如图所示,根据相关信息回答下列问题:
-4e-=2H2O+2CO2。如图所示,根据相关信息回答下列问题:
①正极的电极反应为____________
②当甲池中A电极理论上消耗H2的体积为448mL(标准状况)时,乙池中C、D两电极质量变化量之差为________ g。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.CH4(g)+H2O(g)⇌CO(g)+3H2(g)∆H=+206.4kJ
 mol-1
mol-1Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H=-44.1kJ
 mol-1
mol-1根据上述信息请写出甲烷水蒸气催化重整的热化学反应方程式:
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1mol H2O(g),利用反应Ⅰ制备H2,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2L)。
①恒温,恒容时,能判断反应Ⅰ一定处于化学平衡状态的依据是
A.混合气体的压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.混合气体的平均相对分子质量不随时间改变
②a、b两容器的温度

(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中CO2参与电极反应。工作时负极的电极反应为2H2+2CO
 -4e-=2H2O+2CO2。如图所示,根据相关信息回答下列问题:
-4e-=2H2O+2CO2。如图所示,根据相关信息回答下列问题:①正极的电极反应为
②当甲池中A电极理论上消耗H2的体积为448mL(标准状况)时,乙池中C、D两电极质量变化量之差为

您最近半年使用:0次
名校
解题方法
5 . 合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2(s)]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l) 2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=
2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=___ 。关于该反应的下列说法正确的是___ (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
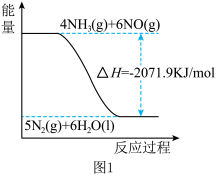
②尿素在一定条件下可将氮的氧化物还原为氮气,结合①及图1中信息,尿素还原NO(g)为N2的热化学方程式是___ 。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)___ b点的逆反应速率v逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是___ 。

(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2gNO2和Na2CO3溶液完全反应时生成两种盐并转移电子0.1mol,此反应的化学反应方程式是___ 。
(1)尿素[CO(NH2)2(s)]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l)
 2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=
2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气,结合①及图1中信息,尿素还原NO(g)为N2的热化学方程式是

③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)
 CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2gNO2和Na2CO3溶液完全反应时生成两种盐并转移电子0.1mol,此反应的化学反应方程式是
您最近半年使用:0次
名校
解题方法
6 . Ⅰ.FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是______________ 。
(2)FeCl3在溶液中分三步水解:
Fe3+ + H2O⇌Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O⇌Fe(OH) + H+ K2
+ H+ K2
Fe(OH) + H2O⇌Fe(OH)3+ H+ K3
+ H2O⇌Fe(OH)3+ H+ K3
①以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________
②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为: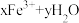 ⇌
⇌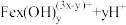 。欲使平衡正向移动可采用的方法是(填序号)
。欲使平衡正向移动可采用的方法是(填序号)________ 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
③室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件___________
Ⅱ.向50mL 0.018 mol·L-1的AgNO3溶液中加入50mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
(1)①完全沉淀后,溶液中c(Ag+)=________ 。
②完全沉淀后,溶液的pH=________ 。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成________ (填“是”或“否”)。
(1)FeCl3净水的原理是
(2)FeCl3在溶液中分三步水解:
Fe3+ + H2O⇌Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O⇌Fe(OH)
 + H+ K2
+ H+ K2Fe(OH)
 + H2O⇌Fe(OH)3+ H+ K3
+ H2O⇌Fe(OH)3+ H+ K3①以上水解反应的平衡常数K1、K2、K3由大到小的顺序是
②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:
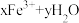 ⇌
⇌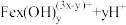 。欲使平衡正向移动可采用的方法是(填序号)
。欲使平衡正向移动可采用的方法是(填序号)a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
③室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件
Ⅱ.向50mL 0.018 mol·L-1的AgNO3溶液中加入50mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
(1)①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成
您最近半年使用:0次
2020-11-11更新
|
268次组卷
|
2卷引用:甘肃省静宁县第一中学2020-2021学年高二上学期第二次月考(实验班)化学试题
名校
7 . 利用真空碳热还原冶炼镁、铝及锰的单质或合金是冶金工业的热点之一。回答下列问题:
(1)已知体系自由能变化 时反应能自发进行。
时反应能自发进行。 真空碳热还原冶炼镁的主要反应为
真空碳热还原冶炼镁的主要反应为 ,其自由能变化与温度、压强的关系如图所示:
,其自由能变化与温度、压强的关系如图所示:
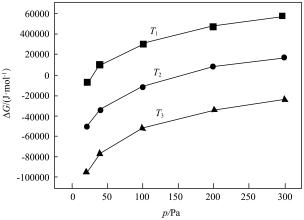
温度由低到高的顺序是_________ , 时该反应不能自发进行的温度是
时该反应不能自发进行的温度是_______ (填“ ”“
”“ ”或“
”或“ ”)。
”)。
(2) 提出的碳热还原
提出的碳热还原 冶炼
冶炼 的机理如下:
的机理如下:
(Ⅰ)
(Ⅱ)
(Ⅲ)
则反应 的
的
__________ kJ/mol(用含a、b、c的代数式表示)。
(3)制备锰合金的相关反应及平衡时 与温度的关系如图所示(
与温度的关系如图所示( 为用分压表示的平衡常数,分压=总压×体积分数):
为用分压表示的平衡常数,分压=总压×体积分数):
(Ⅰ)
(Ⅱ)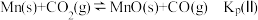
(Ⅲ)

① 的反应是
的反应是___________ (填标号)。
②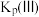
____________ [用 、
、 表示];A点
表示];A点
___________ 用[ 表示]。
表示]。
③向某恒容密闭容器中充入 并加入足量
并加入足量 ,若只发生反应:
,若只发生反应: ,达到B点的平衡状态。达到平衡前,v(正)
,达到B点的平衡状态。达到平衡前,v(正)__________ v(逆)(填“大于”“小于”或“等于”),达到平衡时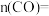
_______________ (保留小数点后两位)。
(1)已知体系自由能变化
 时反应能自发进行。
时反应能自发进行。 真空碳热还原冶炼镁的主要反应为
真空碳热还原冶炼镁的主要反应为 ,其自由能变化与温度、压强的关系如图所示:
,其自由能变化与温度、压强的关系如图所示:
温度由低到高的顺序是
 时该反应不能自发进行的温度是
时该反应不能自发进行的温度是 ”“
”“ ”或“
”或“ ”)。
”)。(2)
 提出的碳热还原
提出的碳热还原 冶炼
冶炼 的机理如下:
的机理如下:(Ⅰ)

(Ⅱ)

(Ⅲ)

则反应
 的
的
(3)制备锰合金的相关反应及平衡时
 与温度的关系如图所示(
与温度的关系如图所示( 为用分压表示的平衡常数,分压=总压×体积分数):
为用分压表示的平衡常数,分压=总压×体积分数):(Ⅰ)

(Ⅱ)
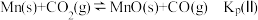
(Ⅲ)


①
 的反应是
的反应是②
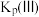
 、
、 表示];A点
表示];A点
 表示]。
表示]。③向某恒容密闭容器中充入
 并加入足量
并加入足量 ,若只发生反应:
,若只发生反应: ,达到B点的平衡状态。达到平衡前,v(正)
,达到B点的平衡状态。达到平衡前,v(正)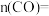
您最近半年使用:0次
名校
8 . 近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:


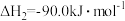
写出 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式_____ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是______ (填序号)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比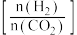 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
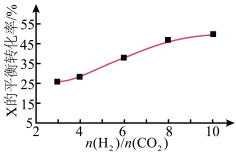
反应物X是___ (填“ ”或“
”或“ ”)。
”)。
(4)250℃时,在体积为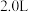 的恒容密闭容器中加入
的恒容密闭容器中加入 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。
①前10min内 的平均反应速率
的平均反应速率
____  。
。
②化学平衡常数
________ 。
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为___ (填实验编号)。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:



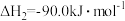
写出
 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由
 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比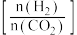 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
反应物X是
 ”或“
”或“ ”)。
”)。(4)250℃时,在体积为
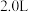 的恒容密闭容器中加入
的恒容密闭容器中加入 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。①前10min内
 的平均反应速率
的平均反应速率
 。
。②化学平衡常数

③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
实验编号 | 温度/K | 催化剂 |
| 甲醇的选择性/% |
A | 543 |
|
|
|
B | 543 |
|
|
|
C | 553 |
|
|
|
D | 553 |
|
|
|
根据上表所给数据,用
 生产甲醇的最优条件为
生产甲醇的最优条件为
您最近半年使用:0次
2020-10-10更新
|
338次组卷
|
8卷引用:甘肃省武威市民勤县第一中学2020-2021学年高二上学期12月月考化学试题(理科)
甘肃省武威市民勤县第一中学2020-2021学年高二上学期12月月考化学试题(理科)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第4节 化学反应条件的优化——工业合成氨 高效手册人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第四节 化学反应的调控四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题广东省江门市新会区陈经纶中学2022-2023学年高二上学期第5段月考化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控
名校
解题方法
9 . 实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有________________ (任写两种)。
(2)气体X是____ ,滤渣1溶于一定浓度硫酸溶液后,加热到70~80℃可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5)n]m,则该物质中铁元素的化合价为________ 。溶液采用的加热方式为________ ,控制温度70~80℃的原因是________________ 。若溶液的pH偏小,将导致聚铁中铁的质量分数________ (填“偏高”、“偏低”或“无影响”)。
(3)加入H2O2的目的是________________ 。若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为________________ 。
(4)“一系列操作”主要包括加入足量盐酸,然后经过________________ 、过滤、洗涤,即得到氯化镁晶体。

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有
(2)气体X是
(3)加入H2O2的目的是
(4)“一系列操作”主要包括加入足量盐酸,然后经过
您最近半年使用:0次
2020-09-25更新
|
1566次组卷
|
5卷引用:甘肃省白银市会宁县第一中学2020-2021学年高二上学期第二次月考化学试题
甘肃省白银市会宁县第一中学2020-2021学年高二上学期第二次月考化学试题山西省实验中学2021届高三9月月考化学试题山西省实验中学2020-2021学年高三上学期第一次月考化学试题江西省赣州市赣县第三中学2021-2022学年高二下学期5月月考化学试题(已下线)模拟卷04-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)
名校
解题方法
10 . 硫酸盐(含 、
、 )气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
)气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
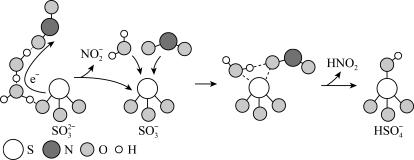
下列说法不正确的是( )
 、
、 )气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
)气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
下列说法不正确的是( )
| A.该过程有 H2O 参与 | B.NO2是生成硫酸盐的还原剂 |
| C.硫酸盐气溶胶呈酸性 | D.该过程中有硫氧键生成 |
您最近半年使用:0次
2020-09-10更新
|
868次组卷
|
10卷引用:甘肃省白银市会宁县第四中学2021届高三上学期第一次月考化学试题
甘肃省白银市会宁县第四中学2021届高三上学期第一次月考化学试题北京市延庆区2021届高三上学期统测(9月)考试化学试题福建省厦门实验中学2021届高三上学期十月份月考化学试题重庆市第一中学校2020-2021高三上学期第一次月考化学试题河北省尚义县第一中学2021届高三上学期期中考试化学试题重庆市第七中学2021届高三上学期第一次月考化学试题天津市南开区2021届高三上学期期中质量调查化学试题广东省2021届高三“六校联盟”第三次联考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题陕西省宝鸡市、汉中市部分校联考2022-2023学年高三上学期11月月考化学试题

 纳米棒
纳米棒