用硫酸分解磷尾矿[主要成分为Ca5(PO4)3F]可制得中强酸磷酸。已知:25 ℃时,H3PO4的电离平衡常数:K1=7.1×10−3;K2=6.3×10−8;K3=4.2×10−13.请回答:
(1)NaH2PO4溶液中c(HP )
) ___________ c(H3PO4)(填“>”“<”或“=”)。
(2)25 ℃时,H2P (aq)+OH-(aq)
(aq)+OH-(aq)  HP
HP (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=___________ 。
(3)Ca5(PO4)3F(s)+OH-(aq) Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
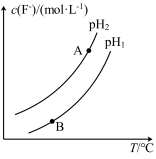
则:pH1___________ pH2(填“>”“<”或“=”,下同);A、B两点的溶液中用F-表示的反应速率υ(A)___________ υ(B)。
(4)下列说法正确的是___________
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中 的值增大
的值增大
D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
(1)NaH2PO4溶液中c(HP
 )
) (2)25 ℃时,H2P
 (aq)+OH-(aq)
(aq)+OH-(aq)  HP
HP (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=(3)Ca5(PO4)3F(s)+OH-(aq)
 Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
则:pH1
(4)下列说法正确的是
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中
 的值增大
的值增大D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
更新时间:2020-12-11 00:27:48
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】请根据题目要求回答以下问题:
(1)CuSO4·5H2O的摩尔质量是__________ ; 0.1mol CH4含有的氢原子数为_____ ; 0.2 mol·L-1的 AlCl3溶液中Cl-的物质的量浓度是__________ 。
(2)现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是__________ ,属于弱电解质的是____ 。(填序号),写出Ba(OH)2的电离方程式_________ .
(1)CuSO4·5H2O的摩尔质量是
(2)现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】(1)如果一个化学反应在5min内,反应物的物质的量浓度由6mol·L-1减小到2mol·L-1,则该反应在5min内的平均反应速率为_____________ 。
(2)H2O2可分解为H2O和O2,请提出两种可加快该反应速率的方法:_____________ 、_____________ 。
(3)某同学进行如下实验,探究化学反应中的能量变化。

通过实验测出,反应后①烧杯中的温度升高,②烧杯中的温度降低。由此判断Ba(OH)2·8H2O与NH4Cl的反应是__________ (填“吸热”或“放热”)反应。试写出①中反应的离子方程式:______________________________ 。
(2)H2O2可分解为H2O和O2,请提出两种可加快该反应速率的方法:
(3)某同学进行如下实验,探究化学反应中的能量变化。

通过实验测出,反应后①烧杯中的温度升高,②烧杯中的温度降低。由此判断Ba(OH)2·8H2O与NH4Cl的反应是
您最近一年使用:0次
【推荐3】碳和硫的化合物在生产生活中的应用非常广泛。
⑴用生物质热解气(主要成分为CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g) + SO2 (g) = S(g) + 2CO2(g) ΔH1 = +8.0kJ/mol
2CO(g) + O2 (g) = 2CO2(g) ΔH2 = -566.0kJ/mol
2H2 (g) + O2 (g) = 2H2O (g) ΔH3 = -483.6kJ/mol
则2H2 (g) + SO2 (g) = S(g) + 2 H2O (g) ΔH4 =________
⑵欲用1L Na2CO3溶液将6.99gBaSO4固体全部转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为________ 。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11, Ksp(BaCO3)=1×10-10]
(3)在25 ℃时,将a mol/L的氨水溶液与0.02mol/L的HCl溶液等体积混合后溶液呈中性,则氨水的电离平衡常数Kb =________ 。
⑴用生物质热解气(主要成分为CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g) + SO2 (g) = S(g) + 2CO2(g) ΔH1 = +8.0kJ/mol
2CO(g) + O2 (g) = 2CO2(g) ΔH2 = -566.0kJ/mol
2H2 (g) + O2 (g) = 2H2O (g) ΔH3 = -483.6kJ/mol
则2H2 (g) + SO2 (g) = S(g) + 2 H2O (g) ΔH4 =
⑵欲用1L Na2CO3溶液将6.99gBaSO4固体全部转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
(3)在25 ℃时,将a mol/L的氨水溶液与0.02mol/L的HCl溶液等体积混合后溶液呈中性,则氨水的电离平衡常数Kb =
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】如表所示是几种常见弱酸的电离方程式和电离常数( ):
):
请回答下列问题:
(1)弱电解质的电离常数K只与温度有关,当温度升高时,K______ (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的电离常数K不同,那么电离常数K的大小与酸性的相对强弱的关系为_____ 。
(3)若把 、
、 、
、 、
、 、
、 、
、 、
、 、
、 都看作酸,其中酸性最强的是
都看作酸,其中酸性最强的是_________ ,最弱的是__________ 。
 ):
):酸 | 电离方程式 | 电离常数 |
|  | 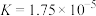 |
|   | 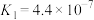  |
| 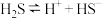  | 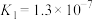  |
| 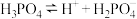   | 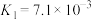   |
请回答下列问题:
(1)弱电解质的电离常数K只与温度有关,当温度升高时,K
(2)在温度相同时,各弱酸的电离常数K不同,那么电离常数K的大小与酸性的相对强弱的关系为
(3)若把
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 都看作酸,其中酸性最强的是
都看作酸,其中酸性最强的是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
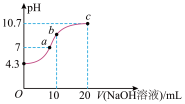
①写出H2N2O2在水溶液中的电离方程式:__ 。
②c点时溶液中各离子浓度由大到小的顺序为__ 。
③b点时溶液中c(H2N2O2)__ c(N2O22-)。(填“>”“<”或“=”,下同)
④a点时溶液中c(Na+)__ c(HN2O)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 =
=__ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(3)有时我们将NaHCO3溶液中的平衡表示为:2HCO3- H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理
H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理___ (填序号)
A.适当浓度的盐酸
B.适当浓度Ba(OH)2溶液
C.适当浓度BaCl2溶液
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②c点时溶液中各离子浓度由大到小的顺序为
③b点时溶液中c(H2N2O2)
④a点时溶液中c(Na+)
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
 =
=(3)有时我们将NaHCO3溶液中的平衡表示为:2HCO3-
 H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理
H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理A.适当浓度的盐酸
B.适当浓度Ba(OH)2溶液
C.适当浓度BaCl2溶液
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】表中是几种常见弱酸的电离平衡常数(25℃),回答下列问题:
(1)Ka只与温度有关,当温度升高时,Ka值___________ (填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的Ka值不同,那么Ka值的大小与酸性的相对强弱有何关系___________ 。
(3)若把CH3COOH、H2CO3、HCO 、HClO、H3PO4、H2PO
、HClO、H3PO4、H2PO 、
、 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是___________ ,最弱的是___________ 。
(4)电离平衡常数是用实验的方法测定出来的,现测得25℃时,c mol∙L−1的CH3COOH的电离度为,试表示该温度下醋酸的电离平衡常数
___________ 。
(5)根据上表中提供的H2CO3和HClO的电离平衡常数,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
A.c(HCO )>c(ClO-)>c(OH-)
)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO )>c(H+)
)>c(H+)
C.c(HClO)+c(ClO-)=c(HCO )+c(H2CO3)
)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO )+c(ClO-)+c(OH-)
)+c(ClO-)+c(OH-)
(6)根据上表中H2CO3和HClO的电离平衡常数,试写出少量CO2通入到NaClO溶液中的化学反应方程式___________ 。
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH CHCOO-+H+ CHCOO-+H+ | Ka=1.7×10−5 |
| H2CO3 | H2CO3 HCO HCO +H+ +H+HCO   CO CO +H+ +H+ | Ka1=4.2×10−7 Ka2=5.6×10−11 |
| HClO | HClO ClO-+H+ ClO-+H+ | Ka=4.7×10−8 |
| H3PO4 | H3PO4 H2PO H2PO +H+ +H+H2PO    +H+ +H+  PO PO +H+ +H+ | Ka1=7.1×10−3 Ka2=6.2×10−8 Ka3=4.5×10−13 |
(2)在温度相同时,各弱酸的Ka值不同,那么Ka值的大小与酸性的相对强弱有何关系
(3)若把CH3COOH、H2CO3、HCO
 、HClO、H3PO4、H2PO
、HClO、H3PO4、H2PO 、
、 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是(4)电离平衡常数是用实验的方法测定出来的,现测得25℃时,c mol∙L−1的CH3COOH的电离度为,试表示该温度下醋酸的电离平衡常数

(5)根据上表中提供的H2CO3和HClO的电离平衡常数,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
A.c(HCO
 )>c(ClO-)>c(OH-)
)>c(ClO-)>c(OH-)B.c(ClO-)>c(HCO
 )>c(H+)
)>c(H+) C.c(HClO)+c(ClO-)=c(HCO
 )+c(H2CO3)
)+c(H2CO3)D.c(Na+)+c(H+)=c(HCO
 )+c(ClO-)+c(OH-)
)+c(ClO-)+c(OH-)(6)根据上表中H2CO3和HClO的电离平衡常数,试写出少量CO2通入到NaClO溶液中的化学反应方程式
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】已知MOH为一元弱碱,25℃时,电离常数Kb=1×10- 6 mol·L-1。25℃时,0.01 mol·L-1 MOH溶液的pH=10,将其与等体积pH=4的盐酸溶液混合,则混合溶液的pH_____ 7(填“>”、“<”或“=”),试求此时溶液中MCl的水解平衡常数Kh=__________ mol/L。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】25℃时,H2SO3⇌HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3的水解平衡常数Kh=____________ ,若向NaHSO3溶液中加入少量的I2,则溶液中 将
将__________ (填“增大”“减小”或“不变”)。
 将
将
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】请回答下列问题:25℃时,部分物质的电离平衡常数如表所示。
(1)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________ 。
a. b.
b. c.
c.
(2)在25℃时对氨水进行如下操作,请填写下列空白。
若向氨水中加入稀硫酸,使氨水恰好被中和,所得溶液的pH______ (填“>”“=”或“<”)7,用离子方程式表示其原因:_______ 。
(3)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为_______ 。
(4)25℃时NaHSO3的水解平衡常数Kb=_______ (结果保留1位有效数字)。向NaHSO3溶液滴加石蕊溶液后变红,则HSO 的电离程度
的电离程度_______ (其水解程度填“>”或“=”或“<”)。
| 化学式 | CH3COOH | NH3•H2O | H2CO3 | H2SO3 |
| 电离平衡常数 | 1.75×10-5 | 1.8×10-5 | K1=4.5×10-7 K2=4.7×10-11 | K1=1.4×10-2 K2=6.0×10-8 |
a.
 b.
b. c.
c.
(2)在25℃时对氨水进行如下操作,请填写下列空白。
若向氨水中加入稀硫酸,使氨水恰好被中和,所得溶液的pH
(3)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为
(4)25℃时NaHSO3的水解平衡常数Kb=
 的电离程度
的电离程度
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】写出下列反应的离子方程式。
(1)向Na2S2O3溶液中加入稀硫酸_____________________________________________________________
(2)在Mg(OH)2悬浊液中加入FeCl3溶液,沉淀变为红褐色____________________________________
(3)Mg(OH)2沉淀溶于NH4Cl溶液中______________________________________________________
(1)向Na2S2O3溶液中加入稀硫酸
(2)在Mg(OH)2悬浊液中加入FeCl3溶液,沉淀变为红褐色
(3)Mg(OH)2沉淀溶于NH4Cl溶液中
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】(1)在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2的混合溶液中逐滴加入氨水,先生成_________ 填化学式)沉淀,生成该沉淀的离子方程式为_________________________ 。
已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
=_____________ 。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
 =
=
您最近一年使用:0次

 产品中
产品中 元素含量,实验步骤如下:
元素含量,实验步骤如下: 产品于锥形瓶中,加入足量
产品于锥形瓶中,加入足量 溶液,再加稀硝酸至酸性;
溶液,再加稀硝酸至酸性; 的
的 溶液
溶液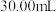 ,使
,使 完全沉淀;
完全沉淀;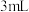 硝基苯,用力摇动,其目的是
硝基苯,用力摇动,其目的是 溶液滴定过量
溶液滴定过量 至终点,记下所用体积
至终点,记下所用体积 。
。 是白色沉淀,
是白色沉淀,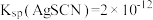 。
。



