1 . 2019年12月20日,美国总统特朗普签署了2020财政年度国防授权法案,对俄罗斯向欧洲进行天然气输出的“北溪2号”管道项目实施制裁,实施“美国优先发展战略”。天然气 既是一种优质能源,又是一种重要化工原料,甲烷水蒸气催化重整制备高纯氢是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.CH4(g)+H2O(g)⇌CO(g)+3H2(g)∆H=+206.4kJ mol-1
mol-1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H=-44.1kJ mol-1
mol-1
根据上述信息请写出甲烷水蒸气催化重整的热化学反应方程式:_____
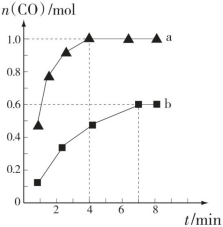
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1mol H2O(g),利用反应Ⅰ制备H2,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2L)。
①恒温,恒容时,能判断反应Ⅰ一定处于化学平衡状态的依据是______ (填写字母序号)。
A.混合气体的压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.混合气体的平均相对分子质量不随时间改变
②a、b两容器的温度______ (填“相同”“不相同”或“不确定”);容器a中CH4从反应开始到恰好平衡时的平均反应速率为______ ,在该温度下反应的化学平衡常数K=_____ 。
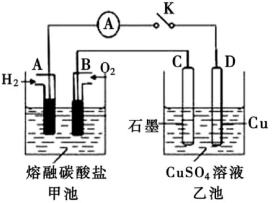
(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中CO2参与电极反应。工作时负极的电极反应为2H2+2CO -4e-=2H2O+2CO2。如图所示,根据相关信息回答下列问题:
-4e-=2H2O+2CO2。如图所示,根据相关信息回答下列问题:
①正极的电极反应为____________
②当甲池中A电极理论上消耗H2的体积为448mL(标准状况)时,乙池中C、D两电极质量变化量之差为________ g。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.CH4(g)+H2O(g)⇌CO(g)+3H2(g)∆H=+206.4kJ
 mol-1
mol-1Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H=-44.1kJ
 mol-1
mol-1根据上述信息请写出甲烷水蒸气催化重整的热化学反应方程式:
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1mol H2O(g),利用反应Ⅰ制备H2,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2L)。
①恒温,恒容时,能判断反应Ⅰ一定处于化学平衡状态的依据是
A.混合气体的压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.混合气体的平均相对分子质量不随时间改变
②a、b两容器的温度

(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中CO2参与电极反应。工作时负极的电极反应为2H2+2CO
 -4e-=2H2O+2CO2。如图所示,根据相关信息回答下列问题:
-4e-=2H2O+2CO2。如图所示,根据相关信息回答下列问题:①正极的电极反应为
②当甲池中A电极理论上消耗H2的体积为448mL(标准状况)时,乙池中C、D两电极质量变化量之差为

您最近一年使用:0次
名校
解题方法
2 . Ⅰ.FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是______________ 。
(2)FeCl3在溶液中分三步水解:
Fe3+ + H2O⇌Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O⇌Fe(OH) + H+ K2
+ H+ K2
Fe(OH) + H2O⇌Fe(OH)3+ H+ K3
+ H2O⇌Fe(OH)3+ H+ K3
①以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________
②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为: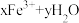 ⇌
⇌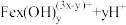 。欲使平衡正向移动可采用的方法是(填序号)
。欲使平衡正向移动可采用的方法是(填序号)________ 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
③室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件___________
Ⅱ.向50mL 0.018 mol·L-1的AgNO3溶液中加入50mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
(1)①完全沉淀后,溶液中c(Ag+)=________ 。
②完全沉淀后,溶液的pH=________ 。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成________ (填“是”或“否”)。
(1)FeCl3净水的原理是
(2)FeCl3在溶液中分三步水解:
Fe3+ + H2O⇌Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O⇌Fe(OH)
 + H+ K2
+ H+ K2Fe(OH)
 + H2O⇌Fe(OH)3+ H+ K3
+ H2O⇌Fe(OH)3+ H+ K3①以上水解反应的平衡常数K1、K2、K3由大到小的顺序是
②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:
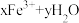 ⇌
⇌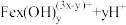 。欲使平衡正向移动可采用的方法是(填序号)
。欲使平衡正向移动可采用的方法是(填序号)a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
③室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件
Ⅱ.向50mL 0.018 mol·L-1的AgNO3溶液中加入50mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
(1)①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成
您最近一年使用:0次
2020-11-11更新
|
270次组卷
|
2卷引用:甘肃省静宁县第一中学2020-2021学年高二上学期第二次月考(实验班)化学试题
名校
解题方法
3 . 硫酸盐(含 、
、 )气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
)气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
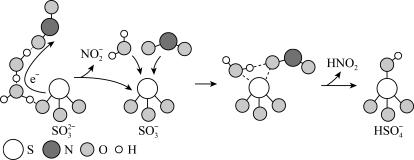
下列说法不正确的是( )
 、
、 )气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
)气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
下列说法不正确的是( )
| A.该过程有 H2O 参与 | B.NO2是生成硫酸盐的还原剂 |
| C.硫酸盐气溶胶呈酸性 | D.该过程中有硫氧键生成 |
您最近一年使用:0次
2020-09-10更新
|
874次组卷
|
10卷引用:甘肃省白银市会宁县第四中学2021届高三上学期第一次月考化学试题
甘肃省白银市会宁县第四中学2021届高三上学期第一次月考化学试题北京市延庆区2021届高三上学期统测(9月)考试化学试题福建省厦门实验中学2021届高三上学期十月份月考化学试题重庆市第一中学校2020-2021高三上学期第一次月考化学试题河北省尚义县第一中学2021届高三上学期期中考试化学试题重庆市第七中学2021届高三上学期第一次月考化学试题天津市南开区2021届高三上学期期中质量调查化学试题广东省2021届高三“六校联盟”第三次联考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题陕西省宝鸡市、汉中市部分校联考2022-2023学年高三上学期11月月考化学试题
名校
解题方法
4 . 煤和天然气都是重要的化石资源,在工业生产中用途广泛。
(1)燃煤时往往在煤中添加石灰石,目的是_____ ,达到该目的时发生反应的化学方程式为_____ 。
(2)煤的综合利用包括____ (将煤隔绝空气加强热)、煤的气化和液化。煤的气化是将其转化为可燃性气体的过程,主要发生的反应的化学方程式为____ 。
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g) △H。 查阅资料得出相关数据如下:
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S_____ (填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为__ 。
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。

①200 °C时,该反应的平衡常数K=______ 。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是________ 。
③压强:p1_____ (填“>”“<”或“=”)p2。
(1)燃煤时往往在煤中添加石灰石,目的是
(2)煤的综合利用包括
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g) △H。 查阅资料得出相关数据如下:
温度/°C | 400 | 500 |
平衡常数K | 9 | 5.3 |
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。

①200 °C时,该反应的平衡常数K=
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③压强:p1
您最近一年使用:0次
2020-08-08更新
|
528次组卷
|
6卷引用:甘肃省白银市靖远县2019-2020学年高二下学期期末考试化学试题
甘肃省白银市靖远县2019-2020学年高二下学期期末考试化学试题(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)2.4+化学反应进行的方向-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.4化学反应进行的方向(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)江西省赣州市会昌县会昌中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】9. 2020 高二上 十九中 期中 颜毅
5 . 研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减弱温室效应具有重要的意义。
工业上CO2与CH4发生反应Ⅰ:CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g) H2O(g)+CO(g) ∆H2=+41 kJ·mol−1
H2O(g)+CO(g) ∆H2=+41 kJ·mol−1
(1)已知部分化学键的键能数据如下表所示:
则∆Hl =_______ kJ·mol−1,反应Ⅰ在一定条件下能够自发进行的原因是________________ ,该反应工业生产适宜的温度和压强为_______ (填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1∶1投料制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923 K时CO2的平衡转化率大于CH4的原因是________________________ 。
②计算923 K时反应Ⅱ的化学平衡常数K=______ (计算结果保留小数点后两位)。
③1200 K以上CO2和CH4的平衡转化率趋于相等的原因可能是_______________ 。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______________________ 。

②为了提高该反应中CH4的转化率,可以采取的措施是________________________ 。
(4)高温电解技术能高效实现下列反应:CO2+H2O CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式_____ 。
工业上CO2与CH4发生反应Ⅰ:CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)
 H2O(g)+CO(g) ∆H2=+41 kJ·mol−1
H2O(g)+CO(g) ∆H2=+41 kJ·mol−1(1)已知部分化学键的键能数据如下表所示:
| 化学键 | C—H | H—H | C=O |  |
| 键能(kJ·mol−1) | 413 | 436 | 803 | 1076 |
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1∶1投料制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923 K时CO2的平衡转化率大于CH4的原因是
②计算923 K时反应Ⅱ的化学平衡常数K=
③1200 K以上CO2和CH4的平衡转化率趋于相等的原因可能是
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是

②为了提高该反应中CH4的转化率,可以采取的措施是
(4)高温电解技术能高效实现下列反应:CO2+H2O
 CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO2在电极a放电的电极反应式
您最近一年使用:0次
解题方法
6 . 2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕。一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO) 等一碳化合物在化工 、医药,能源等方面都有着广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1molHCHO过程中能量变化如图1。
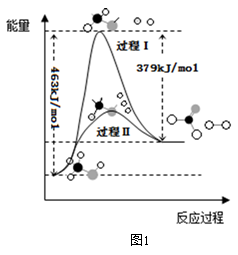
已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ•mol-1,则反应CO2(g)+2H2(g)=HCHO(g) +H2O(g) △H=___________ kJ•mol-1。
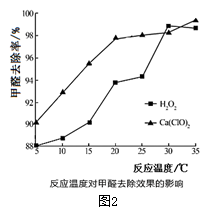
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为__________ (填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g) CH3OH(g) △H=akJ•mol-1
CH3OH(g) △H=akJ•mol-1
①按 =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a_____ (填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________ 。
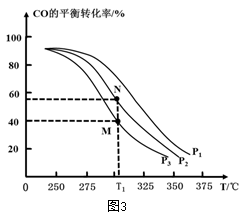
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol•L-1。达到平衡时,CO的转化率为图3中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为__________ (保留3位有效数字)。
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取H2:CH4(g) +H2O(g) CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
由上还数据可得该温度下,c2=____________ ,该反应的逆反应速率常数k=______ L3•mol-3•min-1)。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1molHCHO过程中能量变化如图1。

已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ•mol-1,则反应CO2(g)+2H2(g)=HCHO(g) +H2O(g) △H=
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为

(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g)
 CH3OH(g) △H=akJ•mol-1
CH3OH(g) △H=akJ•mol-1①按
 =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol•L-1。达到平衡时,CO的转化率为图3中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取H2:CH4(g) +H2O(g)
 CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 8.0 |
| c2 | c1 | 16.0 |
| c2 | 0.15 | 6.75 |
由上还数据可得该温度下,c2=
您最近一年使用:0次
名校
解题方法
7 . 甲烷催化裂解、氧气部分氧化和水煤气重整是目前制氢的常用方法。回答下列问题:
(1)甲烷隔绝空气分解,部分反应如下:
Ⅰ.CH4(g)=C(s)+2H2(g) ∆H1=+74.9kJ/mol
Ⅱ.6CH4(g)=C6H6(g)+9H2(g) ∆H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) ∆H3=+202kJ/mol
①反应I的△S___ (填“>”或“<”)0。
②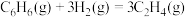 的 △H=
的 △H=______ kJ/mol。
(2)CH4用水蒸气重整制氢包含的反应为:
Ⅰ.水蒸气重整: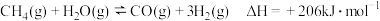
Ⅱ.水煤气变换: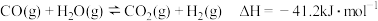
平衡时各物质的物质的量分数如图所示:___________ (写一条)。
②温度高于T1℃时,CO2的物质的量分数开始减小,其原因是___________ 。
③T2℃时,容器中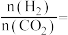
______________ 。
(3)甲烷部分氧化反应为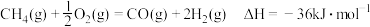 。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示: 的InKp=
的InKp=________ 。
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1 atm。H2的平衡分压p(H2)=____ atm;此温度下反应的lnKp=___ (已知;ln3≈l.1,ln4≈l.4)。
(1)甲烷隔绝空气分解,部分反应如下:
Ⅰ.CH4(g)=C(s)+2H2(g) ∆H1=+74.9kJ/mol
Ⅱ.6CH4(g)=C6H6(g)+9H2(g) ∆H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) ∆H3=+202kJ/mol
①反应I的△S
②
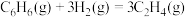 的 △H=
的 △H=(2)CH4用水蒸气重整制氢包含的反应为:
Ⅰ.水蒸气重整:
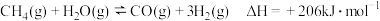
Ⅱ.水煤气变换:
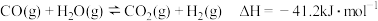
平衡时各物质的物质的量分数如图所示:
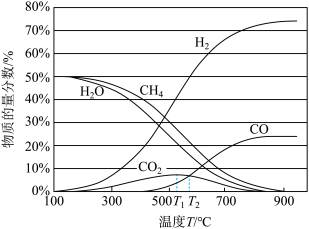
②温度高于T1℃时,CO2的物质的量分数开始减小,其原因是
③T2℃时,容器中
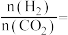
(3)甲烷部分氧化反应为
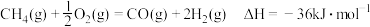 。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示: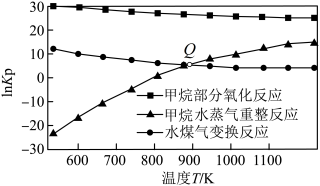
 的InKp=
的InKp=②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1 atm。H2的平衡分压p(H2)=
您最近一年使用:0次
2020-04-14更新
|
595次组卷
|
3卷引用:安徽省2020年江南十校4月综合素质测试(全国I卷)理综化学试题
名校
解题方法
8 . K2 FeO4在水中不稳定,发生反应: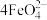 +l0H2O
+l0H2O 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
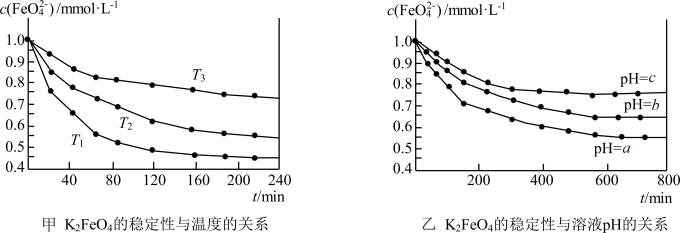
 +l0H2O
+l0H2O 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 
| A.由图甲可知上述反应 △H < 0 |
| B.由图甲可知温度:T1 > T2 > T3 |
| C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱 |
| D.由图乙可知图中a < c |
您最近一年使用:0次
2019-12-29更新
|
656次组卷
|
5卷引用:【全国百强校】甘肃省兰州市第一中学2018届高三考前最后冲刺模拟化学试题
9 . 炽热的炉膛内有反应:C(s)+O2(g)=CO2(g) ΔH=-392kJ·mol-1,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131kJ·mol-1,2CO(g)+O2(g)=2CO2(g) ΔH=-564kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH=-482kJ·mol-1由以上反应推断往炽热的炉膛内通入水蒸气时( )
| A.不能节约燃料,但能使炉膛火更旺 | B.虽不能使炉膛火更旺,但可节约燃料 |
| C.既可使炉膛火更旺,又能节约燃料 | D.既不能使炉膛火更旺,又不能节约燃料 |
您最近一年使用:0次
2019-12-24更新
|
128次组卷
|
4卷引用:湖北省黄冈市浠水县实验高级中学2019-2020学年高二上学期期中复习检测化学试题
10 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___ 。
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___ mol•L-1•min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
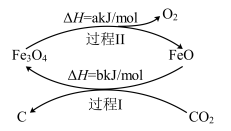
①在转化过程中起催化作用的物质是___ ;
②写出总反应的化学方程式___ 。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H___ 0。(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___ ;B点处,NH3的平衡转化率为___ 。
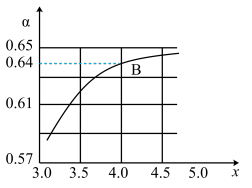
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)
 C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g)
 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的
 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
您最近一年使用:0次
2019-12-06更新
|
709次组卷
|
6卷引用:甘肃省兰州市第七中学2021届高三上学期12月月考理综化学题



