1 . 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示。其中X、Y、Z三种元素的质子数之和为21。
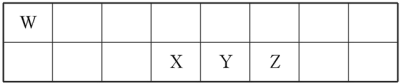
(1)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是_______ (用化学用语表示);该溶液中各种离子浓度由大到小的顺序为_______ 。
(2)由XW4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为_____ 。
(3)已知:2YZ2(g)⇌Y2Z4(g) ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
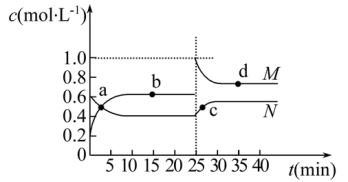
①a、b、c、d四个点中,化学反应处于平衡状态的是点_______ 。
②25min时,增加了_______ (填物质的化学式)_______ mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______ (填字母)。

(1)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是
(2)由XW4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为
(3)已知:2YZ2(g)⇌Y2Z4(g) ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。

①a、b、c、d四个点中,化学反应处于平衡状态的是点
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
您最近一年使用:0次
名校
解题方法
2 . 氮及其化合物的转化过程如图所示。下列分析合理的是
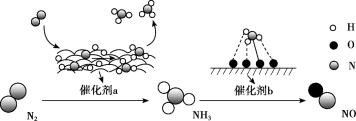

| A.催化剂a表面只发生极性共价键的断裂和形成 |
| B.N2与H2反应生成NH3的原子利用率为100% |
| C.在催化剂b表面形成氮氧键时,不涉及电子转移 |
| D.催化剂a、b能提高反应的平衡转化率 |
您最近一年使用:0次
2021-05-19更新
|
787次组卷
|
23卷引用:山东省2020届高三模拟考试化学试题
山东省2020届高三模拟考试化学试题山东省潍坊市昌乐县2020年高三上学期第一次高考模拟化学试题山东省2020届普通高中学业水平等级考试 · 模拟卷(三)化学试题【区级联考】北京市朝阳区2019届高三下学期二模考试化学试题云南省玉溪一中2020届高三上学期期中考试理综化学试题辽宁省沈阳市五校协作体2020届高三上学期期中考试化学试题北京市石景山区精华学校2019-2020学年高三上学期二次月考化学试题河北省枣强中学2019-2020学年高二下学期第三次月考化学试题北京市房山区2020届高三一模化学试题天津市南开区2020届高三上学期期末考试化学试题福建省福州市2019届高三5月高考模拟化学试题新疆吾尔自治区乌鲁木齐市第七十中学2021届高三上学期第一次月考(9月)化学试题安徽省涡阳县第一中学2021届高三上学期第二次月考化学试题湖南省张家界市2020-2021学年高二上学期期末考试化学试题福建省莆田第一中学2020-2021学年高二下学期期中考试化学试题天津市西青区张家窝中学2022届高三上学期第一次月考化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-测试(已下线)2022年江苏卷高考真题变式题1-13湖南省长沙市宁乡市2020-2021学年高二下学期期末调研考试化学试题(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题6-10)北京市中国人民大学附属中学朝阳学校2021-2022学年高三上学期第一次月考化学试题陕西省榆林市2023-2024学年高二上学期10月月考化学试题(已下线)物质反应及转化
名校
解题方法
3 . 氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)→2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k•c(N2O)•[c(I2)]0.5(k为速率常数)。下列表述正确的是
第一步I2(g)→2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k•c(N2O)•[c(I2)]0.5(k为速率常数)。下列表述正确的是
| A.N2O分解反应中,k(含碘)>k(无碘) | B.第一步对总反应速率起决定作用 |
| C.第二步活化能比第三步小 | D.I2浓度与N2O分解速率无关 |
您最近一年使用:0次
2021-03-12更新
|
362次组卷
|
3卷引用:湖南省攸县第三中学2020届高三第五次月考化学试题
解题方法
4 . 乙二酸(H2C2O4)俗称草酸,为无色晶体,是二元弱酸,广泛分布于植物、动物和真菌体中,在实验研究和化学工业中应用广泛。回答下列问题:
(1)工业上可由以下反应制取草酸:
I.4CO(g)+4C4H9OH(l)+O2(g)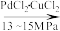 2(COOC4H9)2(l)+2H2O(l)
2(COOC4H9)2(l)+2H2O(l)
II.(COOC4H9)2(l)+2H2O(l) H2C2O4(l)+2C4H9OH(l)
H2C2O4(l)+2C4H9OH(l)
①反应I选择13~15 MPa的高压条件下进行,最主要的原因是为了___________ ,若5min内c(O2)减少了0.15 mol·L-1,则用CO表示的反应速率为___________ mol·L-1·min-1
②对于反应II,下列能够说明其已经达到平衡状态的是___________ (填序号)。
a.溶液的pH保持不变
b.平衡常数K保持不变
c.丁醇的浓度保持不变
d.反应液的总质量保持不变
(2)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:

①某温度下,测得0.1 mol·L-1 H2C2O4溶液的pH=1.3,此时草酸的电离方程式为___________ 。
②向10 mL 0.1 mol·L-1 H2C2O4溶液中逐滴加入0.1 mol·L-1 NaOH溶液,当溶液中c(Na+)=2c( )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)___________ 10 mL(填“>”“=”或“<”),若加入NaOH溶液体积为20 mL,此时溶液中阴离子浓度的大小顺序为___________ ;当pH=2.7时,溶液中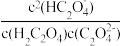 =
=___________ 。
(1)工业上可由以下反应制取草酸:
I.4CO(g)+4C4H9OH(l)+O2(g)
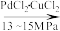 2(COOC4H9)2(l)+2H2O(l)
2(COOC4H9)2(l)+2H2O(l)II.(COOC4H9)2(l)+2H2O(l)
 H2C2O4(l)+2C4H9OH(l)
H2C2O4(l)+2C4H9OH(l)①反应I选择13~15 MPa的高压条件下进行,最主要的原因是为了
②对于反应II,下列能够说明其已经达到平衡状态的是
a.溶液的pH保持不变
b.平衡常数K保持不变
c.丁醇的浓度保持不变
d.反应液的总质量保持不变
(2)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:

①某温度下,测得0.1 mol·L-1 H2C2O4溶液的pH=1.3,此时草酸的电离方程式为
②向10 mL 0.1 mol·L-1 H2C2O4溶液中逐滴加入0.1 mol·L-1 NaOH溶液,当溶液中c(Na+)=2c(
 )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)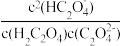 =
=
您最近一年使用:0次
名校
解题方法
5 . 研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法的不正确的是
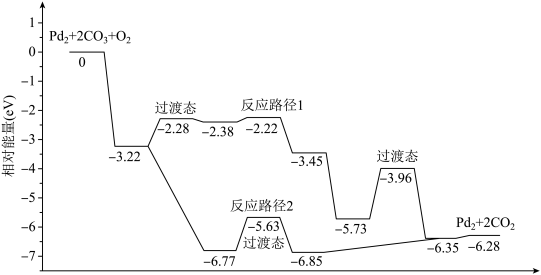

| A.该过程中有极性键和非极性键的断裂和生成 |
| B.反应路径2的催化效果更好 |
| C.催化剂不会改变整个反应的ΔH |
| D.路径1中最大能垒(活化能)E正=1.23eV |
您最近一年使用:0次
2020-12-08更新
|
1113次组卷
|
7卷引用:湖北省武汉市东西湖区华中师范大学第一附属中学2021届高三上学期期中考试化学试题
6 . 下列图示与对应的叙述不相符的是( )
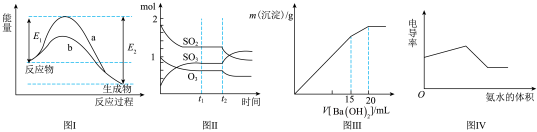

| A.图Ⅰ表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化 |
B.图Ⅱ表示一定条件下进行的反应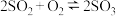 各成分的物质的量变化, 各成分的物质的量变化, 时刻改变的条件可能是缩小容器体积 时刻改变的条件可能是缩小容器体积 |
C.图Ⅲ表示某明矾溶液中加入 溶液,沉淀的质量与加入 溶液,沉淀的质量与加入 溶液体积的关系,在加入 溶液体积的关系,在加入 溶液时铝离子恰好沉淀完全 溶液时铝离子恰好沉淀完全 |
| D.电导率可表示溶液导电性的强弱,电导率越大导电性越强,图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系 |
您最近一年使用:0次
解题方法
7 . 以废旧磷酸亚铁锂电池正极片( 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。

回答下列问题:
(1) 中Fe元素的化合价为
中Fe元素的化合价为_________ ;“放电处理”有利于锂在正极的回收,其原因是__________ 。
(2)“碱浸”中发生反应的离子方程式为________________________________ 。
(3)“浸取”中加入 的作用为
的作用为________________ ;“沉铁”过程所得滤渣为白色固体,其主要成分是________________ 。
(4)已知碳酸锂的分解温度为 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是________________ ; 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为_____ 。
(5)写出“焙烧”过程中生成锰酸锂的化学方程式_________________________________ 。
 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。
回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“碱浸”中发生反应的离子方程式为
(3)“浸取”中加入
 的作用为
的作用为(4)已知碳酸锂的分解温度为
 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为(5)写出“焙烧”过程中生成锰酸锂的化学方程式
您最近一年使用:0次
2020-11-24更新
|
567次组卷
|
2卷引用:山东省临沂市2021届高三上学期期中考试化学试题
8 . 一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,其是重要的水的消毒剂。
(1)写出NH2Cl的电子式____________________ 。
(2)写出NH2Cl与水反应的化学方程式___________________________ 。
(3)一定条件下(T ℃、1 atm),可以用Cl2(g)和NH3(g)制得NH2Cl(g)同时得到HCl(g)。
已知部分化学键的键能如表所示:
写出该反应的热化学方程式____________________________________ 。
(1)写出NH2Cl的电子式
(2)写出NH2Cl与水反应的化学方程式
(3)一定条件下(T ℃、1 atm),可以用Cl2(g)和NH3(g)制得NH2Cl(g)同时得到HCl(g)。
已知部分化学键的键能如表所示:
| 化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
| 键能/(kJ·mol-1) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式
您最近一年使用:0次
名校
解题方法
9 . 电化学原理在工业生产中发挥着巨大的作用。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4

①阳极的电极反应式为_______
②阴极产生的气体为________
③右侧的离子交换膜为________ (填“阴”或“阳”)离子交换膜,阴极区a%_______ b%(填“>”“=”或“<”)
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH )
)_________ (填“>”“<”或“=”)c(NO )。
)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为_______ 。
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是______ g。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4

①阳极的电极反应式为
②阴极产生的气体为
③右侧的离子交换膜为
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH
 )
) )。
)。②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是
您最近一年使用:0次
2020-10-18更新
|
1014次组卷
|
2卷引用:山东省实验中学2021届高三上学期第一次诊断考试化学试题
名校
解题方法
10 . 综合利用CO2、CO对构建低碳社会有重要意义。
(1) Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为____ 。
(2) 固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c发生的电极反应式:___________ 、_____________ 。

(3) 电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)⇌CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g)。此时向容器中再通入0.35 mol CO气体,则此平衡将_____ (填“向正反应方向”“不”或“向逆反应方向”)移动。
(4) 已知:
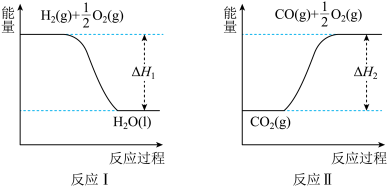
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)⇌CH3OH(l)的ΔH,则ΔH=_____ 。
(5) 利用太阳能和缺铁氧化物可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物与足量CO2完全反应可生成______ mol C(碳)。

(1) Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为
(2) 固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c发生的电极反应式:

(3) 电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)⇌CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g)。此时向容器中再通入0.35 mol CO气体,则此平衡将
(4) 已知:

若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)⇌CH3OH(l)的ΔH,则ΔH=
(5) 利用太阳能和缺铁氧化物可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物与足量CO2完全反应可生成

您最近一年使用:0次



