名校
解题方法
1 . 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ、反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ、
①反应A的热化学方程式是___________ 。
②A中反应物所具有的焓___________ 生成物所具有的焓(填“大于”或“小于”)。
③断开1molH-O键与断开1molH-Cl键所需能量相差约为___________ kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)___________ 。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
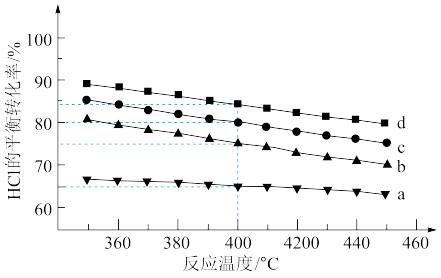
①曲线b对应的投料比是___________ 。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是___________ 。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是___________ 。
反应A:4HCl+O2
 2Cl2+2H2O
2Cl2+2H2O(1)已知:ⅰ、反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ、

①反应A的热化学方程式是
②A中反应物所具有的焓
③断开1molH-O键与断开1molH-Cl键所需能量相差约为
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是
您最近半年使用:0次
名校
2 . 氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为___________ 。
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH。在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示。
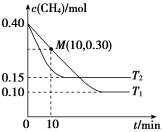
①根据如图判断该反应的ΔH___________ 0(填“>”“<”或“=”),理由是___________ 。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=___________ ,反应的平衡常数K=___________ (保留一位小数)。
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有___________ (填编号)。
A.改用高效催化剂 B.升高温度 C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH___________ (填“增大”“减小”或“不变”),负极的电极反应式为___________ 。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH。在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示。

①根据如图判断该反应的ΔH
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有
A.改用高效催化剂 B.升高温度 C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH
您最近半年使用:0次
3 . 平衡,可逆反应的宿命,可逆反应永恒的话题。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应,4s后达到平衡状态。CO+H2O(g)⇌CO2+H2;△H<0
①CO和H2O的浓度变化如下图所示,则在0~4s时正反应的平均反应速率为v(CO2)=_______ mol·L-1·min-1
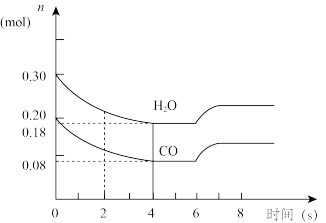
②图中6~7s之间反应向_______ (填左、右或不)移动,原因可能是_______ (填字母代号)
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.增大压强 F.只充入CO2
(2)在25℃下,将amol·L-1的醋酸与0.01mol·L-1的NaOH等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显_______ 性(填“酸”“碱”或“中”);用含a的代数式表示CH3COOH的电离常数Ka=_______ 。
(3)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈_______ 性(填“酸”、“碱”或“中”),NH4HCO3溶液呈_______ 性(填“酸”、“碱”或“中”),NH4HCO3溶液中浓度最大的离子是_______ (填离子的名称)
(4)已知常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=1.0×10-38。现有0.1mol·L-1的CuCl2溶液中含有Fe3+,调节pH=3.0使Fe3+沉淀完全[即当c(Fe3+)<10-5mol·L-1时认为沉淀完全]此时Cu2+是否开始沉淀_______ (填“是”或“否”)。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应,4s后达到平衡状态。CO+H2O(g)⇌CO2+H2;△H<0
①CO和H2O的浓度变化如下图所示,则在0~4s时正反应的平均反应速率为v(CO2)=

②图中6~7s之间反应向
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.增大压强 F.只充入CO2
(2)在25℃下,将amol·L-1的醋酸与0.01mol·L-1的NaOH等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显
(3)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈
(4)已知常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=1.0×10-38。现有0.1mol·L-1的CuCl2溶液中含有Fe3+,调节pH=3.0使Fe3+沉淀完全[即当c(Fe3+)<10-5mol·L-1时认为沉淀完全]此时Cu2+是否开始沉淀
您最近半年使用:0次
4 . 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示。其中X、Y、Z三种元素的质子数之和为21。
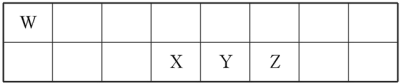
(1)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是_______ (用化学用语表示);该溶液中各种离子浓度由大到小的顺序为_______ 。
(2)由XW4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为_____ 。
(3)已知:2YZ2(g)⇌Y2Z4(g) ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
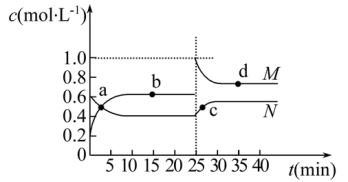
①a、b、c、d四个点中,化学反应处于平衡状态的是点_______ 。
②25min时,增加了_______ (填物质的化学式)_______ mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______ (填字母)。

(1)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是
(2)由XW4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为
(3)已知:2YZ2(g)⇌Y2Z4(g) ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。

①a、b、c、d四个点中,化学反应处于平衡状态的是点
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
您最近半年使用:0次
解题方法
5 . 丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。
(1)已知:I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) ∆H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) ∆H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)⇌C3H6(g)+H2(g)的∆H为___________ kJ·mol-1
(2)一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,发生丙烷脱氢制丙烯反应。
①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是___________ (填字母)。
A.该反应的焓变保持不变 B.气体平均摩尔质量保持不变
C.气体密度保持不变 D.C3H8分解速率与C3H6消耗速率相等
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图a所示。此温度下该反应的平衡常数Kp=___________ kPa(用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。

③已知上述反应中,v正=k正·p(C3H8),v逆=k逆·p(C3H6)•p(H2),其中k正、k逆为速率常数,只与温度有关,则图a中m点处 =
=___________
(3)保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是___________ 、___________ ;425℃之后,丙烯产率快速降低的主要原因可能是___________ 。

(4)以丙烷为燃料制作新型燃料电池,电解质是熔融碳酸盐。请写出电池的正极电极反应式___________ ;放电时 移向电池的
移向电池的___________ (填“正”或“负”)极。
(1)已知:I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) ∆H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) ∆H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)⇌C3H6(g)+H2(g)的∆H为
(2)一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,发生丙烷脱氢制丙烯反应。
①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是
A.该反应的焓变保持不变 B.气体平均摩尔质量保持不变
C.气体密度保持不变 D.C3H8分解速率与C3H6消耗速率相等
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图a所示。此温度下该反应的平衡常数Kp=

③已知上述反应中,v正=k正·p(C3H8),v逆=k逆·p(C3H6)•p(H2),其中k正、k逆为速率常数,只与温度有关,则图a中m点处
 =
=(3)保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是

(4)以丙烷为燃料制作新型燃料电池,电解质是熔融碳酸盐。请写出电池的正极电极反应式
 移向电池的
移向电池的
您最近半年使用:0次
6 . “水煤气(CO和 )”是化学工业常用的原料气,请回答:
)”是化学工业常用的原料气,请回答:
I.已知:焦炭、CO的标准燃烧热分别为 、
、 ,氢气燃烧的热化学反应方程式:
,氢气燃烧的热化学反应方程式: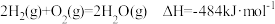
(1)试写出由焦炭和水蒸气生成水煤气的热化学反应方程式:___________
(2)下列说法正确的是___________
II.合成氨工厂以“水煤气”为原料,采用两段间接换热式绝热反应器(反应器中的催化剂对原料气的吸附时间长短,对原料气的转化率会造成一定影响)在常压下进行转换合成氨,装置如图。
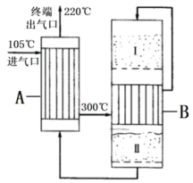
A反应器中主要发生的反应为: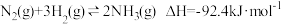
B反应器中主要发生的反应为:
主反应: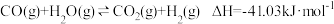
副反应:
由进气口充入一定量含CO、 、
、 、
、 的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、
的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、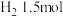 、
、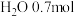 、
、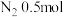 、
、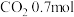 和
和 。
。
已知标准平衡常数: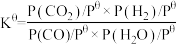 ,其中
,其中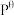 表示标准压强(
表示标准压强( )
)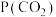 、
、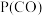 、
、 、
、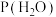 表示各组分的分压,如
表示各组分的分压,如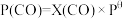 ,
, 为体系中CO的物质的量分数
为体系中CO的物质的量分数
(3)T℃时,主反应的压强平衡常数
___________
(4)平衡时CO的转化率为___________
(5)进气空速对反应产品的收率有一定的影响,实验测得在不同进气空速下,测得平衡时 的收率如下图所示
的收率如下图所示
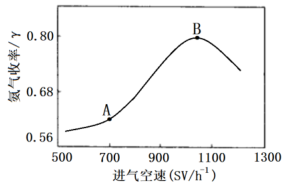
①曲线中A点到B点变化的原因是:___________
②若将绝热转换反应器改为恒温转换反应器,试在图中画出随进气空速变化的 收率曲线
收率曲线___ 。
 )”是化学工业常用的原料气,请回答:
)”是化学工业常用的原料气,请回答:I.已知:焦炭、CO的标准燃烧热分别为
 、
、 ,氢气燃烧的热化学反应方程式:
,氢气燃烧的热化学反应方程式: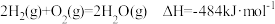
(1)试写出由焦炭和水蒸气生成水煤气的热化学反应方程式:
(2)下列说法正确的是___________
| A.将煤炭在空气中直接加强热进行干馏,制备生成水煤气的原料焦炭 |
| B.水煤气可经过催化合成获得液体燃料、碳氢化合物和含氧有机物 |
| C.水煤气也可采用高温下煤和水蒸气直接作用制得 |
| D.在恒压反应釜中,利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成 |
II.合成氨工厂以“水煤气”为原料,采用两段间接换热式绝热反应器(反应器中的催化剂对原料气的吸附时间长短,对原料气的转化率会造成一定影响)在常压下进行转换合成氨,装置如图。

A反应器中主要发生的反应为:
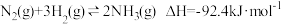
B反应器中主要发生的反应为:
主反应:
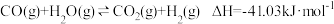
副反应:

由进气口充入一定量含CO、
 、
、 、
、 的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、
的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、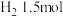 、
、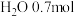 、
、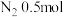 、
、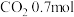 和
和 。
。已知标准平衡常数:
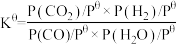 ,其中
,其中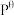 表示标准压强(
表示标准压强( )
)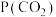 、
、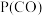 、
、 、
、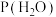 表示各组分的分压,如
表示各组分的分压,如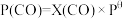 ,
, 为体系中CO的物质的量分数
为体系中CO的物质的量分数(3)T℃时,主反应的压强平衡常数

(4)平衡时CO的转化率为
(5)进气空速对反应产品的收率有一定的影响,实验测得在不同进气空速下,测得平衡时
 的收率如下图所示
的收率如下图所示
①曲线中A点到B点变化的原因是:
②若将绝热转换反应器改为恒温转换反应器,试在图中画出随进气空速变化的
 收率曲线
收率曲线
您最近半年使用:0次
2021-10-20更新
|
632次组卷
|
3卷引用:2020年全国卷Ⅱ化学真题变式题
解题方法
7 . 二氧化硫在工业上和生活中有广泛的用途。
工业用SO2和O2反应合成SO3反应的反应热(ΔH)、活化能(Ea正)为:SO2(g)+ O2(g)
O2(g) SO3(g)ΔH=-98.0kJ·mol-1Ea正=125.5kJ·mol-1
SO3(g)ΔH=-98.0kJ·mol-1Ea正=125.5kJ·mol-1
(1)三氧化硫的分解反应SO3(g) SO2(g)+
SO2(g)+ O2(g)的活化能Ea正=
O2(g)的活化能Ea正=___________ 。
(2)下列关于工业用SO2和O2反应合成SO3反应的理解正确的是___________。
(3)在1L体积可变的密闭容器,维持温度为500°C,压强为1×105Pa和初始n(SO2)=2mol,充入一定量的O2,发生可逆反应:2SO2(g)+O2(g) 2SO3(g)ΔH=-196kJ·mol-1,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g)ΔH=-196kJ·mol-1,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
①在500°C时,SO2平衡转化率随着O2物质的量的增大而升高,解释其原因___________ 。
②其他条件不变,若改为在1L体积不变的密闭容器中发生上述可逆反应,请在下图中画出SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系图___________ 。
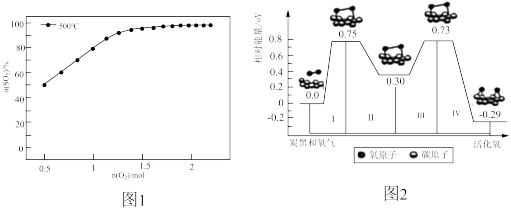
(4)已知活化氧可以把SO2快速氧化为SO3.根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化如图2所示。下列说法不正确的是___________。
(5)已知标准状况下,1L水能溶解VL二氧化硫气体,且饱和溶液中的SO2有 与水反应生成H2SO3,测得c(H+)=0.2mol·L-1.计算该条件下的V=
与水反应生成H2SO3,测得c(H+)=0.2mol·L-1.计算该条件下的V=___________ (已知H2SO3的第一步电离平衡常数Ka1=0.02,忽略第二步电离和溶液体积的变化,保留小数点后2位)。
工业用SO2和O2反应合成SO3反应的反应热(ΔH)、活化能(Ea正)为:SO2(g)+
 O2(g)
O2(g) SO3(g)ΔH=-98.0kJ·mol-1Ea正=125.5kJ·mol-1
SO3(g)ΔH=-98.0kJ·mol-1Ea正=125.5kJ·mol-1(1)三氧化硫的分解反应SO3(g)
 SO2(g)+
SO2(g)+ O2(g)的活化能Ea正=
O2(g)的活化能Ea正=(2)下列关于工业用SO2和O2反应合成SO3反应的理解正确的是___________。
| A.增大氧气浓度,活化分子百分数增大,有效碰撞频率增大,反应速率加快 |
| B.该反应的实际工业生产条件是高温、高压、合适的催化剂 |
| C.当温度、压强一定时,在原料气(SO2和O2的比例不变)中添加少量惰性气体,会使平衡转化率减小 |
| D.反应过程中,可将SO3液化,并不断将液态SO3移去,有利于提高正反应速率 |
 2SO3(g)ΔH=-196kJ·mol-1,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g)ΔH=-196kJ·mol-1,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:①在500°C时,SO2平衡转化率随着O2物质的量的增大而升高,解释其原因
②其他条件不变,若改为在1L体积不变的密闭容器中发生上述可逆反应,请在下图中画出SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系图

(4)已知活化氧可以把SO2快速氧化为SO3.根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化如图2所示。下列说法不正确的是___________。
| A.O2转化为活化氧是氧氧键的断裂与碳氧键的生成过程 |
| B.每活化一个O2吸收0.29eV的能量 |
| C.该过程中的最大能垒(活化能)Ea正=1.02eV |
| D.该催化反应的反应物在一定条件下达到相对能量为0.75eV的过渡态后,无需加热就能发生后续反应II、III和IV |
 与水反应生成H2SO3,测得c(H+)=0.2mol·L-1.计算该条件下的V=
与水反应生成H2SO3,测得c(H+)=0.2mol·L-1.计算该条件下的V=
您最近半年使用:0次
2021-09-17更新
|
968次组卷
|
2卷引用:2020年全国卷Ⅰ理综化学高考真题变式题
名校
8 . 天然气的主要成分为CH4,一般还含有C2H6(乙烷)等,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)⇌C2H4(g)+H2(g) ΔH,若容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_______ r1。
②对于处于初期阶段的该反应,下列说法正确的是_______ 。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
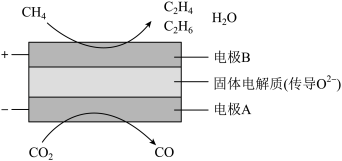
①阴极上的反应式为_______ 。
②若生成的乙烯(C2H4)和乙烷(C2H6)的体积比为2:1,则消耗的CH4和CO2体积比为_______ 。
(1)乙烷在一定条件可发生如下反应:C2H6(g)⇌C2H4(g)+H2(g) ΔH,若容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=
(2)高温下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
②对于处于初期阶段的该反应,下列说法正确的是
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的反应式为
②若生成的乙烯(C2H4)和乙烷(C2H6)的体积比为2:1,则消耗的CH4和CO2体积比为
您最近半年使用:0次
9 . 多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。

回答下列问题:
(1)硅粉与HCl在300℃时反应生成1molSiHCl3气体和H2,放出225kJ热量,该反应的热化学方程式为_______ 。SiHCl3的电子式为_______ 。
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)⇌SiHCl3(g)+HCl(g) ΔH1˃0
②3SiCl4(g)+2H2(g)+Si(s)⇌4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)⇌3SiHCl3(g) ΔH3
ΔH3=_______ (用ΔH1,ΔH2表示)。温度升高,反应③的平衡常数K_______ (填“增大”、“减小”或“不变”)。氢化过程中所需的高纯度H2,可用惰性电极电解KOH溶液制备,写出产生H2的电极反应方程式_______ 。
(3)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。三个氢化反应的ΔG与温度的关系如图1所示,可知:反应①能自发进行的最低温度是_______ ;相同温度下,反应②比反应①的ΔG小,主要原因是_______ 。
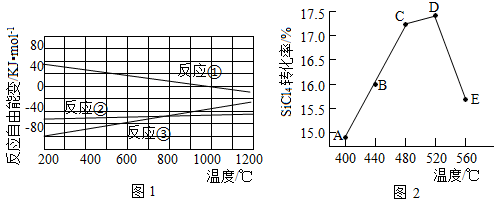
(4)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是_______ (填序号)。
a.B点:υ正>υ逆 b.υ正:A点˃E点 c.反应适宜温度:480~520℃

回答下列问题:
(1)硅粉与HCl在300℃时反应生成1molSiHCl3气体和H2,放出225kJ热量,该反应的热化学方程式为
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)⇌SiHCl3(g)+HCl(g) ΔH1˃0
②3SiCl4(g)+2H2(g)+Si(s)⇌4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)⇌3SiHCl3(g) ΔH3
ΔH3=
(3)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。三个氢化反应的ΔG与温度的关系如图1所示,可知:反应①能自发进行的最低温度是

(4)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是
a.B点:υ正>υ逆 b.υ正:A点˃E点 c.反应适宜温度:480~520℃
您最近半年使用:0次
2021-09-15更新
|
406次组卷
|
2卷引用:河北正定中学2020-2021学年高二上学期开学考试化学试题
名校
10 . 近年来,随着聚酯工业的快速发展,Cl2的需求量和HCl的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl的平衡转化率随温度变化的关系:
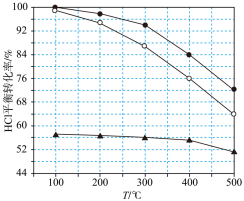
①可知反应平衡常数K(300℃)_______ K(400℃)(填“大于”或“小于”)。
②设HCl初始浓度为c0,根据进料浓度比c(HCl):c(O2)=1:1的数据计算K(400℃)=_______ (列出计算式)。
(2)Deacon直接氧化法可按下列催化过程进行:
2CuCl2(s)=2CuCl(s)+Cl2(g) ΔH1=+166kJ·mol-1
2CuCl(s)+O2(g)=2CuO(s)+Cl2(g) ΔH2=-40kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_______ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是_______ (写出2种)。
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,如下图所示:
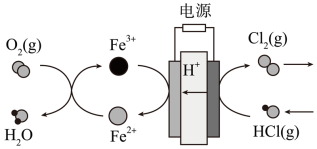
①阴极区发生的反应有_______ ,_______ 。
②电路中转移1mol电子,需消耗氧气_______ L(标准状况)。
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl的平衡转化率随温度变化的关系:

①可知反应平衡常数K(300℃)
②设HCl初始浓度为c0,根据进料浓度比c(HCl):c(O2)=1:1的数据计算K(400℃)=
(2)Deacon直接氧化法可按下列催化过程进行:
2CuCl2(s)=2CuCl(s)+Cl2(g) ΔH1=+166kJ·mol-1
2CuCl(s)+O2(g)=2CuO(s)+Cl2(g) ΔH2=-40kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,如下图所示:

①阴极区发生的反应有
②电路中转移1mol电子,需消耗氧气
您最近半年使用:0次
2021-09-15更新
|
363次组卷
|
2卷引用:河北正定中学2020-2021学年高二上学期开学考试化学试题



