解题方法
1 . 下列反应,其自由能在一定 范围符合给出的关 系式:
(I)2NaHCO3(s) = Na2CO3(g)+ H2O(g)+ CO2(g)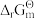 =[129076- 334.2T/K]J· mol-1
=[129076- 334.2T/K]J· mol-1
(II)NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g)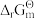 =[171502 - 476.4 T/K]J· mol-1
=[171502 - 476.4 T/K]J· mol-1
以下问题中与上述反应相关的自由能,均可由上述条件式计算,所有分压均须以p 表示。
表示。
(1)计算在 298K时,当NaHCO3(s), Na2CO3(s)和NH4HCO3(s)平衡共存时氨的分压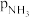
________ 。
(2)将NaHCO3(s), Na2CO3(s)和NH4HCO3(s)放入一个真空容器中平衡后,体系的独立组分数K,相数Φ和自由度f各为多少________ 、________ 、________ ?
(3) 计算当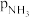 =
= 时,NH4HCO3(s), Na2CO3(s)和NaHCO3(s)平街共存的温度
时,NH4HCO3(s), Na2CO3(s)和NaHCO3(s)平街共存的温度________ 。
(4)在298K时,将Na2CO3(s), NaHCO3(s)和NH4HCO3(s)共同置于密闭容器中,使NH4HCO3(s)免受更多的分解,这种设想能否实现________ ?请用热力学原理计算说明________ 。
(5)在373K,p 条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s), 计算:为避免NaHCO3(s)分解,气流中水的摩尔分数
条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s), 计算:为避免NaHCO3(s)分解,气流中水的摩尔分数________ 。
(6)CO2(g)是温室气体, 焙烧CaCO3(s)时产生过程有两种:
①CaCO3(s)热分解制生石灰,不同温度下的分解压力即CO2的平衡压力示于下表。由CaCO3(s)烧制生石灰时, 若窑中气体不与外界对流,则窑温至少应维持多少度________ ?
②用焦炭作燃料产生CO2:若通入空气的量恰好能使其中的O2完全转化为CO2,燃烧后的气体从窑顶逸出,欲使CaCO3(s)不断分解,窑的温度最低维持多少________ ? (设空气体积分数为21.0% O2和79.0% N2,每种气体均看作理想气体)
(I)2NaHCO3(s) = Na2CO3(g)+ H2O(g)+ CO2(g)
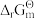 =[129076- 334.2T/K]J· mol-1
=[129076- 334.2T/K]J· mol-1(II)NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g)
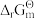 =[171502 - 476.4 T/K]J· mol-1
=[171502 - 476.4 T/K]J· mol-1以下问题中与上述反应相关的自由能,均可由上述条件式计算,所有分压均须以p
 表示。
表示。(1)计算在 298K时,当NaHCO3(s), Na2CO3(s)和NH4HCO3(s)平衡共存时氨的分压
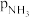
(2)将NaHCO3(s), Na2CO3(s)和NH4HCO3(s)放入一个真空容器中平衡后,体系的独立组分数K,相数Φ和自由度f各为多少
(3) 计算当
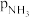 =
= 时,NH4HCO3(s), Na2CO3(s)和NaHCO3(s)平街共存的温度
时,NH4HCO3(s), Na2CO3(s)和NaHCO3(s)平街共存的温度(4)在298K时,将Na2CO3(s), NaHCO3(s)和NH4HCO3(s)共同置于密闭容器中,使NH4HCO3(s)免受更多的分解,这种设想能否实现
(5)在373K,p
 条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s), 计算:为避免NaHCO3(s)分解,气流中水的摩尔分数
条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s), 计算:为避免NaHCO3(s)分解,气流中水的摩尔分数(6)CO2(g)是温室气体, 焙烧CaCO3(s)时产生过程有两种:
①CaCO3(s)热分解制生石灰,不同温度下的分解压力即CO2的平衡压力示于下表。由CaCO3(s)烧制生石灰时, 若窑中气体不与外界对流,则窑温至少应维持多少度
| t/℃ | 600 | 795 | 840 | 880 | 896 | 910 |
p/ p | 0.0132 | 0.210 | 0.421 | 0.763 | 1.00 | 1.32 |
②用焦炭作燃料产生CO2:若通入空气的量恰好能使其中的O2完全转化为CO2,燃烧后的气体从窑顶逸出,欲使CaCO3(s)不断分解,窑的温度最低维持多少
您最近半年使用:0次
名校
2 . 铁、铜及其化合物在日常生活及工业生产中有着非常广泛的用途。回答下列问题:
I.FeCl3是常用的金属蚀刻剂和净水剂。
(1) FeCl3净水的原理是___________ (用离子方程式及语言表示)。
(2)FeCl3在溶液中分三步水解:
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O
 +H+ K2
+H+ K2
 +H2O
+H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是___________ 。
(3)配制FeCl3溶液时,常将FeCl3晶体溶于浓盐酸中,使用时加蒸馏水稀释至指定浓度。
某同学误将FeCl3直接放入自来水(含有Mg2+、Ca2+、 、Cl-等杂质离子)中,看到红褐色沉淀和大量气泡,试解释出现该现象的原因
、Cl-等杂质离子)中,看到红褐色沉淀和大量气泡,试解释出现该现象的原因___________ (用离子方程式表示)。
II. CuCl2 常用作电镀添加剂、催化剂及饲料添加剂。
(4)①25℃时Fe(OH)2、Fe(OH)3、Cu(OH)2的Ksp如表格所示,计算当溶液中Fe2+、Cu2+离子浓度均为0.1 mol/L时,Fe(OH)2沉淀完全及Cu(OH)2开始沉淀时的pH值(已知lg2=0.3)
②在CuCl2溶液中含有少量FeCl2杂质时___________ (填“能"、“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
③为了除去CuCl2溶液中含有的少量FeCl2,可以用___________ (填化学式,写出一种即可) 将FeCl2氧化为FeCl3,然后通过加入___________ (填化学式,出一种即可)调控溶液pH值,使___________ <pH<___________ ,将FeCl3转化为Fe(OH)3除去。
I.FeCl3是常用的金属蚀刻剂和净水剂。
(1) FeCl3净水的原理是
(2)FeCl3在溶液中分三步水解:
Fe3++H2O
 Fe(OH)2++H+ K1
Fe(OH)2++H+ K1Fe(OH)2++H2O

 +H+ K2
+H+ K2 +H2O
+H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3以上水解反应的平衡常数K1、K2、K3由大到小的顺序是
(3)配制FeCl3溶液时,常将FeCl3晶体溶于浓盐酸中,使用时加蒸馏水稀释至指定浓度。
某同学误将FeCl3直接放入自来水(含有Mg2+、Ca2+、
 、Cl-等杂质离子)中,看到红褐色沉淀和大量气泡,试解释出现该现象的原因
、Cl-等杂质离子)中,看到红褐色沉淀和大量气泡,试解释出现该现象的原因II. CuCl2 常用作电镀添加剂、催化剂及饲料添加剂。
(4)①25℃时Fe(OH)2、Fe(OH)3、Cu(OH)2的Ksp如表格所示,计算当溶液中Fe2+、Cu2+离子浓度均为0.1 mol/L时,Fe(OH)2沉淀完全及Cu(OH)2开始沉淀时的pH值(已知lg2=0.3)
| 分子式 | Ksp | 开始沉淀时的pH值 | 沉淀完全时的pH值 |
| Fe(OH)2 | 4.0×10-17 | 6.3 | a= |
| Fe(OH)3 | 2.79×10-39 | 1.5 | 2.8 |
| Cu(OH)2 | 1.6×10-20 | b= | 6.6 |
②在CuCl2溶液中含有少量FeCl2杂质时
③为了除去CuCl2溶液中含有的少量FeCl2,可以用
您最近半年使用:0次
名校
3 . 工业烟气、汽车尾气中的氮氧化物(NOx),可由多种方法进行脱除。
(1)采用NH3作为还原剂,可将NOx还原成N2和H2O。在某催化剂的表面,NH3和NO的反应历程势能变化如图所示(吸附在催化剂表面的物种用*标注)。

该反应历程包括四步基元反应:
a.NH3*+NO*→NH3NO* b.NH3NO*→NH2NO*+H*
c.NH2NO*+H*→HNNOH*+H* d.HNNOH*+H*→H2O*+N2*+H*
由上图可知该反应历程的总△H___ 0(填“>”、“=”或“<”)。整个反应历程中的控速步骤为第___ 步(选填a、b、c或d),其能垒(活化能)为___ Kcal·mol-1。
(2)利用放热反应C(s)+2NO(g) CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
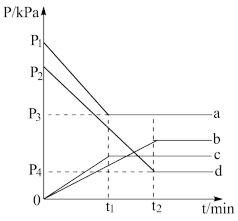
①上中表示500℃条件下pNO的是__ (选填a、b、c或d,下同),表示600℃条件下pCO2的是___ 。
②根据图示,列出600℃时反应平衡常数Kp的计算式__ 。(Kp等于生成物气体分压幂之积与反应物气体分压幂之积的比值)
(3)利用NaClO氧化吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而NO的脱除率如下图所示。

①根据上图,下列有关说法正确的是____ (填标号)。
A.增大压强,NO的转化率增大
B.从化学平衡的角度,采用Ca(ClO)2脱硫效果优于NaClO
C.起始pH=2,脱硝效率随时间降低可能是因为ClO-+Cl-+2H+=Cl2↑+H2O
D.为提高脱硫脱硝效果,应当增大NaClO浓度、提高烟气的流速
②吸收液脱硫效果优于脱硝效果的可能原因是____ (任写一条)。
(1)采用NH3作为还原剂,可将NOx还原成N2和H2O。在某催化剂的表面,NH3和NO的反应历程势能变化如图所示(吸附在催化剂表面的物种用*标注)。

该反应历程包括四步基元反应:
a.NH3*+NO*→NH3NO* b.NH3NO*→NH2NO*+H*
c.NH2NO*+H*→HNNOH*+H* d.HNNOH*+H*→H2O*+N2*+H*
由上图可知该反应历程的总△H
(2)利用放热反应C(s)+2NO(g)
 CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
①上中表示500℃条件下pNO的是
②根据图示,列出600℃时反应平衡常数Kp的计算式
(3)利用NaClO氧化吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而NO的脱除率如下图所示。

①根据上图,下列有关说法正确的是
A.增大压强,NO的转化率增大
B.从化学平衡的角度,采用Ca(ClO)2脱硫效果优于NaClO
C.起始pH=2,脱硝效率随时间降低可能是因为ClO-+Cl-+2H+=Cl2↑+H2O
D.为提高脱硫脱硝效果,应当增大NaClO浓度、提高烟气的流速
②吸收液脱硫效果优于脱硝效果的可能原因是
您最近半年使用:0次
解题方法
4 . 乙烯是现代工业的重要原材料,研究工业制取乙烯有重要的意义。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1
Ⅱ.C2H6(g)+2CO2(g) 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1
反应的能量变化图如图所示:
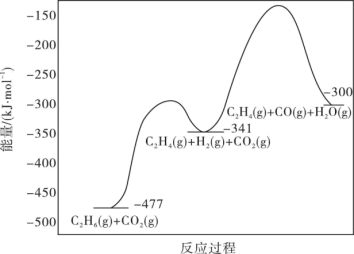
①C2H6(g)+2CO(g)+3H2(g) 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=____ kJ·mol-1
②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是___ ;一定温度和压强下,为了提高反应速率和乙烯的选择性,应当___ 。
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g) C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
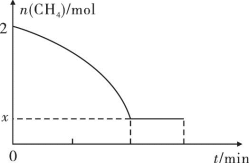
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为____ ;若将温度升高,速率常数增大的倍数:k正___ k逆(填“>”“=”或“<”)。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)
 C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1Ⅱ.C2H6(g)+2CO2(g)
 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1反应的能量变化图如图所示:

①C2H6(g)+2CO(g)+3H2(g)
 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)
 C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为
您最近半年使用:0次
2020-12-26更新
|
1500次组卷
|
3卷引用:北京市昌平区新学道临川学校2021届高三12月月考化学试题
解题方法
5 . 自热化学链重整制氢CLR(a)工艺的原理如图所示:
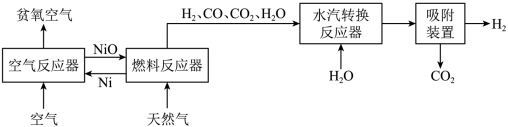
回答下列问题:
(1)25℃、101 kPa时,1.0 g Ni与足量O2反应生成NiO放出8.0 kJ的热量,则在“空气反应器”中发生反应的热化学方程式为_______________ 。
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) △H1=-47.0 kJ∙mol−1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) △H2=+137.7 kJ∙mol−1
(III)CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=+225.5 kJ∙mol−1
则反应CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)的△H=______ kJ∙mol−1。
(3)“水汽转换反应器”中发生的反应为CO(g)+H2O(g) H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正)
H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正) ______ υ(逆)(填“>”“=”或“<”),理由是__________ 。
(4)甲烷制氢传统工艺有水蒸气重整、部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+192 kJ∙mol−1
部分氧化重整反应:CH4(g)+O2(g)=CO2(g)+2H2(g) △H=-748 kJ∙mol−1
采用水蒸气重整的优点是__________ ;若上述两个反应在保持自热条件下(假设无热量损失),理论上1 mol CH4至多可获得H2的物质的量为____________ (结果保留1位小数)。

回答下列问题:
(1)25℃、101 kPa时,1.0 g Ni与足量O2反应生成NiO放出8.0 kJ的热量,则在“空气反应器”中发生反应的热化学方程式为
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) △H1=-47.0 kJ∙mol−1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) △H2=+137.7 kJ∙mol−1
(III)CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=+225.5 kJ∙mol−1
则反应CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)的△H=
(3)“水汽转换反应器”中发生的反应为CO(g)+H2O(g)
 H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正)
H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正) (4)甲烷制氢传统工艺有水蒸气重整、部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+192 kJ∙mol−1
部分氧化重整反应:CH4(g)+O2(g)=CO2(g)+2H2(g) △H=-748 kJ∙mol−1
采用水蒸气重整的优点是
您最近半年使用:0次
名校
6 . 用硫酸分解磷尾矿[主要成分为Ca5(PO4)3F]可制得中强酸磷酸。已知:25 ℃时,H3PO4的电离平衡常数:K1=7.1×10−3;K2=6.3×10−8;K3=4.2×10−13.请回答:
(1)NaH2PO4溶液中c(HP )
) ___________ c(H3PO4)(填“>”“<”或“=”)。
(2)25 ℃时,H2P (aq)+OH-(aq)
(aq)+OH-(aq)  HP
HP (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=___________ 。
(3)Ca5(PO4)3F(s)+OH-(aq) Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
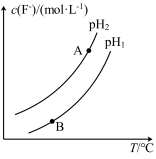
则:pH1___________ pH2(填“>”“<”或“=”,下同);A、B两点的溶液中用F-表示的反应速率υ(A)___________ υ(B)。
(4)下列说法正确的是___________
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中 的值增大
的值增大
D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
(1)NaH2PO4溶液中c(HP
 )
) (2)25 ℃时,H2P
 (aq)+OH-(aq)
(aq)+OH-(aq)  HP
HP (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=(3)Ca5(PO4)3F(s)+OH-(aq)
 Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
则:pH1
(4)下列说法正确的是
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中
 的值增大
的值增大D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
您最近半年使用:0次
2020-12-11更新
|
522次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题
7 . 聚乙烯醇生成中会产生大量副产物乙酸甲酯,乙酸甲酯水解产物可以循环利用。发生水解反应如下:
Ⅰ.CH3COOCH3(l) CH3COOCH3(aq)
CH3COOCH3(aq)
Ⅱ.CH3COOCH3(aq)+H2O(l) CH3COOH(aq)+CH3OH(aq) △H>0 K=1.6×10-11
CH3COOH(aq)+CH3OH(aq) △H>0 K=1.6×10-11
已知:
①H+和OH-对反应II均有催化作用,在相同条件下,相同物质的量的OH-催化效率比H+高。
②乙酸甲酯在水中溶解度0.4mol/100mL,易溶于甲醇,熔点-98.7℃,沸点57.8℃。
(1)在密闭容器中,投入2mol乙酸甲酯和100mL水(如图甲),在50℃下发生水解,得出反应速率与时间图象如图乙所示。



①下列说法正确的是________ 。
A.生成物甲醇,增大了乙酸甲酯在水中的溶解,使得乙酸甲酯在水中的浓度增大
B.反应II是自催化反应,生成物乙酸电离出的H+对反应II具有催化作用
C.pH计或电导率仪(一种测量溶液导电能力的仪器)不可用来检测乙酸乙酯的水解程度
D.t0时刻后水解反应速率下降的原因是水中甲醇浓度太大,阻碍反应II平衡右移
②保持投料、温度不变,若反应开始时向图甲容器中通入适量氯化氢,则反应II的反应速率__________ (填“变大”或“变小”或“不变”),达到平衡时乙酸甲酯转化率__________________ (填“变大”或“变小”或“不变”)。
③保持投料、温度不变,研究碱或酸对反应II催化的效率高低的影响:
甲:加入氢氧化钠固体
乙:通入氯化氢气体
发现水解开始时,甲>乙,水解后期,甲<乙。
试分析水解后期甲<乙原因____________________________ 。
④保持温度不变,乙酸甲酯饱和溶液的平衡转化率为a%,向乙酸甲酯饱和溶液中继续加入VmL水稀释后平衡转化率为x%,在图丙中画出x%与V的变化曲线____________________________ 。
(2)工业上油脂水解是在高温高压下连续水解。水解速率主要取决于油脂与水的接触面积和反应体系中氢离子或氢氧根的浓度。下列说法正确的是_____________
A.高温高压下,体系温度升高,油脂水解反应速率加快
B.高温高压下,促进水的电离,c(H+)和c(OH-)增大,可催化油脂水解反应
C.高温高压下,油脂与水的互溶能力增强,油脂水解反应速率加快
D.高温高压下,油脂水解的平衡常数K比常温常压下的小
Ⅰ.CH3COOCH3(l)
 CH3COOCH3(aq)
CH3COOCH3(aq)Ⅱ.CH3COOCH3(aq)+H2O(l)
 CH3COOH(aq)+CH3OH(aq) △H>0 K=1.6×10-11
CH3COOH(aq)+CH3OH(aq) △H>0 K=1.6×10-11已知:
①H+和OH-对反应II均有催化作用,在相同条件下,相同物质的量的OH-催化效率比H+高。
②乙酸甲酯在水中溶解度0.4mol/100mL,易溶于甲醇,熔点-98.7℃,沸点57.8℃。
(1)在密闭容器中,投入2mol乙酸甲酯和100mL水(如图甲),在50℃下发生水解,得出反应速率与时间图象如图乙所示。



①下列说法正确的是
A.生成物甲醇,增大了乙酸甲酯在水中的溶解,使得乙酸甲酯在水中的浓度增大
B.反应II是自催化反应,生成物乙酸电离出的H+对反应II具有催化作用
C.pH计或电导率仪(一种测量溶液导电能力的仪器)不可用来检测乙酸乙酯的水解程度
D.t0时刻后水解反应速率下降的原因是水中甲醇浓度太大,阻碍反应II平衡右移
②保持投料、温度不变,若反应开始时向图甲容器中通入适量氯化氢,则反应II的反应速率
③保持投料、温度不变,研究碱或酸对反应II催化的效率高低的影响:
甲:加入氢氧化钠固体
乙:通入氯化氢气体
发现水解开始时,甲>乙,水解后期,甲<乙。
试分析水解后期甲<乙原因
④保持温度不变,乙酸甲酯饱和溶液的平衡转化率为a%,向乙酸甲酯饱和溶液中继续加入VmL水稀释后平衡转化率为x%,在图丙中画出x%与V的变化曲线
(2)工业上油脂水解是在高温高压下连续水解。水解速率主要取决于油脂与水的接触面积和反应体系中氢离子或氢氧根的浓度。下列说法正确的是
A.高温高压下,体系温度升高,油脂水解反应速率加快
B.高温高压下,促进水的电离,c(H+)和c(OH-)增大,可催化油脂水解反应
C.高温高压下,油脂与水的互溶能力增强,油脂水解反应速率加快
D.高温高压下,油脂水解的平衡常数K比常温常压下的小
您最近半年使用:0次
名校
解题方法
8 . 合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2(s)]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l) 2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=
2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=___ 。关于该反应的下列说法正确的是___ (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气,结合①及图1中信息,尿素还原NO(g)为N2的热化学方程式是___ 。
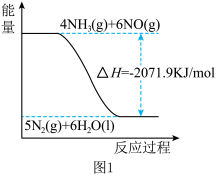
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)___ b点的逆反应速率v逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是___ 。

(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2gNO2和Na2CO3溶液完全反应时生成两种盐并转移电子0.1mol,此反应的化学反应方程式是___ 。
(1)尿素[CO(NH2)2(s)]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l)
 2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=
2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气,结合①及图1中信息,尿素还原NO(g)为N2的热化学方程式是

③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)
 CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2gNO2和Na2CO3溶液完全反应时生成两种盐并转移电子0.1mol,此反应的化学反应方程式是
您最近半年使用:0次
名校
9 . 碘及其化合物在生产中应用广泛。
(1)在2HI(g) H2(g)+ I2(g)反应中,三种分于化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2的物质的量随温度变化的曲线如图2所示。
H2(g)+ I2(g)反应中,三种分于化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2的物质的量随温度变化的曲线如图2所示。
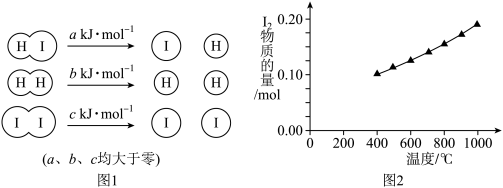
分析图1和图2,比较2a___ b+c(填"<”、“>”或“=”),理由是_________ 。
(2)碱性条件下I2可以转化为IO ,电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。
,电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。
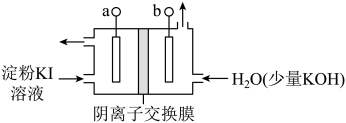
①a连接电源的_____ 极。
②结合实验现象和电极反应式说明制备KIO3的原理:___________ 。
(1)在2HI(g)
 H2(g)+ I2(g)反应中,三种分于化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2的物质的量随温度变化的曲线如图2所示。
H2(g)+ I2(g)反应中,三种分于化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2的物质的量随温度变化的曲线如图2所示。
分析图1和图2,比较2a
(2)碱性条件下I2可以转化为IO
 ,电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。
,电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。
①a连接电源的
②结合实验现象和电极反应式说明制备KIO3的原理:
您最近半年使用:0次
10 . 煤和天然气都是重要的化石资源,在工业生产中用途广泛。
(1)燃煤时往往在煤中添加石灰石,目的是_______ ,达到该目的时发生反应的化学方程式为____________ 。
(2)煤的综合利用包括________ (将煤隔绝空气加强热)、煤的气化和液化。煤的气化是将其转化为可燃性气体的过程,主要发生的反应的化学方程式为_________ 。
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S_____ (填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为_____ 。
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。
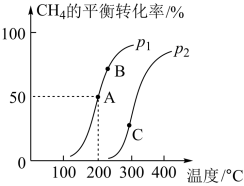
①200 °C时,该反应的平衡常数K=__________ 。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是_________ 。
③压强:p1___________ (填“>”“<”或“=”)p2。
(1)燃煤时往往在煤中添加石灰石,目的是
(2)煤的综合利用包括
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
| 温度/°C | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。

①200 °C时,该反应的平衡常数K=
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③压强:p1
您最近半年使用:0次



