名校
解题方法
1 . 180℃时将0.5 mol H2和1 mol CO2通入2 L的恒容密闭容器中,此时容器内总压强为P0(已知分压=总压×物质的量分数),反应生成甲醇蒸汽(CH3OH)和H2O,测得各物质的物质的量随时间的部分变化如图所示,回答下列问题:

(1)该反应的化学方程式为:___________________
(2)在0~3 min内H2的平均化学反应速率为___________________
(3)0-1分钟的速率为V1,2-3分钟的速率为V2,10-11分钟的速率为V3,则V1、V2、V3由大到小的顺序为____________________________ 。
(4)3min内H2的转化率为______ 。
(5)平衡时,容器内的压强为__________ ,CO2的分压为____________ (均保留2位有效数字)
(6)以(1)中反应设计成原电池(用硫酸作电解质溶液),则正极反应式为______________ 。

(1)该反应的化学方程式为:
(2)在0~3 min内H2的平均化学反应速率为
(3)0-1分钟的速率为V1,2-3分钟的速率为V2,10-11分钟的速率为V3,则V1、V2、V3由大到小的顺序为
(4)3min内H2的转化率为
(5)平衡时,容器内的压强为
(6)以(1)中反应设计成原电池(用硫酸作电解质溶液),则正极反应式为
您最近一年使用:0次
2019高三下·全国·专题练习
2 . NF3是一种有毒、无味、无色的气体,NF3气体作为刻蚀剂和清洗剂在电子工业中有广泛的应用,回答下列问题:
(1)F2和液氨直接反应可制备NF3,反应的化学方程式为_____________________ 。反应过程中会涉及副反应:4F2+2NH3=N2F2+6HF,其中N2F2的结构式可表示为_______________ 。
(2)F2和固态(NH4)3AlF6反应可制备NF3,反应的化学方程式为:(NH4)3AlF6+6F2=2NF3+8HF+NH4AlF4,NH4AlF4+3F2=NF3+4HF+AlF3。若1 mol F2参加反应,最多可制得NF3______ mol,此时反应中转移电子______ mol。
(3)工业上用惰性电极电解含HF、NH4F等无水熔融物的方法生产NF3。电解过程中阳极的电极反应式为_______________________ ,阴极的电极反应式为______________________ 。
(4)一定条件下,向一带活塞的密闭容器中充入1 mol NF3气体,此时容器的体积为V L,在该条件下发生反应2NF3 N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为
N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为_________ mol·L−1。
(1)F2和液氨直接反应可制备NF3,反应的化学方程式为
(2)F2和固态(NH4)3AlF6反应可制备NF3,反应的化学方程式为:(NH4)3AlF6+6F2=2NF3+8HF+NH4AlF4,NH4AlF4+3F2=NF3+4HF+AlF3。若1 mol F2参加反应,最多可制得NF3
(3)工业上用惰性电极电解含HF、NH4F等无水熔融物的方法生产NF3。电解过程中阳极的电极反应式为
(4)一定条件下,向一带活塞的密闭容器中充入1 mol NF3气体,此时容器的体积为V L,在该条件下发生反应2NF3
 N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为
N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为
您最近一年使用:0次
3 . H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的•OH(羟基自由基),•OH可将有机物氧化降解。
(1)Cu2+H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)═CuOOH+(aq)+H+(aq)△H1=a kJ•mol﹣1
CuOOH+(aq)═Cu+(aq)+•OH(aq)+1/2O2(g)△H2=b kJ•mol﹣1
2CuOOH+(aq)═2Cu+(aq)+H2O2(aq)+O2(g)△H3=c kJ•mol﹣1
则H2O2(aq)═2•OH(aq)△H=_____ kJ•mol﹣1。
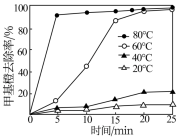
(2)为探究温度对Cu2+H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除速率增大,其原因是_____ 。
(3)为探究Fe2+Cu2+H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+Cu2+H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为_____ 。
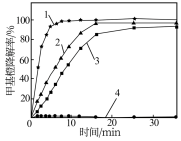
实验条件:200 mL甲基橙模拟废水(1.5 g•L﹣1,pH=3.0),温度60℃、V(H2O2)=2.0 mL
1﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
2﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
3﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
4﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
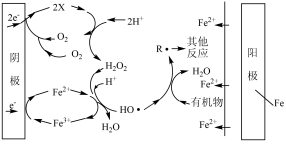
(4)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如下图所示。阳极的电极反应式为_____ ,X微粒的化学式为_____ ,阴极附近Fe2+参与反应的离子方程式为_____ 。
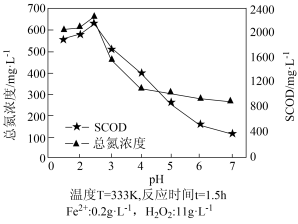
(5)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如上图所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是_____ 。
(1)Cu2+H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)═CuOOH+(aq)+H+(aq)△H1=a kJ•mol﹣1
CuOOH+(aq)═Cu+(aq)+•OH(aq)+1/2O2(g)△H2=b kJ•mol﹣1
2CuOOH+(aq)═2Cu+(aq)+H2O2(aq)+O2(g)△H3=c kJ•mol﹣1
则H2O2(aq)═2•OH(aq)△H=

(2)为探究温度对Cu2+H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除速率增大,其原因是
(3)为探究Fe2+Cu2+H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+Cu2+H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为

实验条件:200 mL甲基橙模拟废水(1.5 g•L﹣1,pH=3.0),温度60℃、V(H2O2)=2.0 mL
1﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
2﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
3﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
4﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(4)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如下图所示。阳极的电极反应式为


(5)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如上图所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是
您最近一年使用:0次
解题方法
4 . 工业上,在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氢气和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(1)一定条件下,在容积为2L的容器内进行该反应,20min时达到平衡,生成N2 0.4mol,则平均反应速率v(NO)=___________________ 。可从混合气体的颜色变化判断上述反应是否达到平衡,其理由是_______________________________________________ 。
(2)工业上也用氨水吸收SO2尾气,最终得到(NH4)2SO4,(NH4)2SO4溶液中c(NH4+)与c(SO42-)之比____ 2:1(选填“>”、“<”、“=”),用离子方程式解释其原因______________________ 。
(3)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚铝酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2+HCl→ClO2↑+NaCl+_____(没有配平)
(4)补全方程式并配平,标出电子转移方向和数目_________________________ 。
(5)该反应中氧化剂和还原剂的物质的量之比是___________ 。若生成0.2molClO2,转移电子数为_____ 个。
 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)(1)一定条件下,在容积为2L的容器内进行该反应,20min时达到平衡,生成N2 0.4mol,则平均反应速率v(NO)=
(2)工业上也用氨水吸收SO2尾气,最终得到(NH4)2SO4,(NH4)2SO4溶液中c(NH4+)与c(SO42-)之比
(3)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚铝酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2+HCl→ClO2↑+NaCl+_____(没有配平)
(4)补全方程式并配平,标出电子转移方向和数目
(5)该反应中氧化剂和还原剂的物质的量之比是
您最近一年使用:0次
2019-04-02更新
|
303次组卷
|
2卷引用:【区级联考】上海市奉贤区2019届高三下学期高考二模化学试题
解题方法
5 . 烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____ (填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______ 。
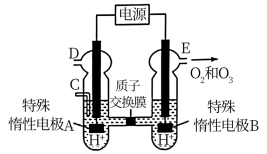

(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____ 。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__ 。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____ 。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳

(5)尿素的制备:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__ 。
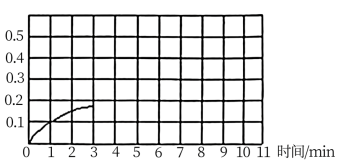
② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________ 。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为


(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳

(5)尿素的制备:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线
您最近一年使用:0次
2019-03-28更新
|
687次组卷
|
3卷引用:【市级联考】浙江台州市2019届高三下学期3月选考科目教学质量评估化学试题
6 . 请根据题目要求回答以下问题:
(1)CuSO4·5H2O的摩尔质量是__________ ; 0.1mol CH4含有的氢原子数为_____ ; 0.2 mol·L-1的 AlCl3溶液中Cl-的物质的量浓度是__________ 。
(2)现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是__________ ,属于弱电解质的是____ 。(填序号),写出Ba(OH)2的电离方程式_________ .
(1)CuSO4·5H2O的摩尔质量是
(2)现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是
您最近一年使用:0次
2019高一下·全国·专题练习
名校
7 . 下图是将SO2 转化为重要的化工原料H2SO4的原理示意图。

请回答下列问题:
(1)该装置将________ 能转化为________ 能,电流方向为________ (填“b→a”或“a→b”)。
(2)催化剂b表面O2发生___________ 反应,其附近酸性________ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_________________________________________ 。
(4)若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为________ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
(4)若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为
您最近一年使用:0次
2019-03-24更新
|
1071次组卷
|
5卷引用:2019年3月22日 《每日一题》必修2 原电池电极反应式的书写
(已下线)2019年3月22日 《每日一题》必修2 原电池电极反应式的书写第二章 化学反应与能量 第二节 化学能与电能(已下线)【全国百强校】云南省曲靖市第一中学2018-2019学年高一5月月考化学试题选择性必修1专题1第二单元 课时2 化学电源1.2.2化学电源 课后
8 . 研究硫元素及其化合物的性质具有重要意义。
Ⅰ.已知I-可以催化二氧化硫与水溶液中发生的歧化反应:
3SO2(g)+2H2O(l) =2H2SO4(aq)+ S(s) △H<0,催化原理分为两步,
第一步反应为吸热的慢反应:SO2 + 4I-+ 4H+ = 2H2O + S↓+ 2I2
第二步反应为放热的快反应:2H2O + I2 +________ = ________ +________ + 2I-
(1)请补充第二步反应
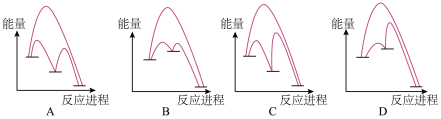
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为_______________
Ⅱ. 工业制硫酸,在接触室发生反应2SO2(g) +O2(g) 2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:

(3)能证明反应已经达到平衡状态的是________________
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2V(SO3)正= V(O2)逆
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4)反应的△H____________ 0(填“>”“<”或“=”)
(5)反应开始到10min时SO2的平均反应速率V(SO2) =_____________ mol/(L.min).
T2时该反应的平衡常数K=________________
(6)一定条件下在恒温恒容的密闭容器中按一定比例充入SO2 (g)和O2 (g),平衡时SO3的体积分数随n(SO2)/n(O2) 的变化图象如图B,则A、B、C 三状态中,SO2的转化率最小的是______________ 点,当n(SO2)/n(O2) =3 时,达到平衡状态SO3的体积分数可能是D、E、F三点中的_____ 点
Ⅰ.已知I-可以催化二氧化硫与水溶液中发生的歧化反应:
3SO2(g)+2H2O(l) =2H2SO4(aq)+ S(s) △H<0,催化原理分为两步,
第一步反应为吸热的慢反应:SO2 + 4I-+ 4H+ = 2H2O + S↓+ 2I2
第二步反应为放热的快反应:2H2O + I2 +
(1)请补充第二步反应
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为

Ⅱ. 工业制硫酸,在接触室发生反应2SO2(g) +O2(g)
 2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
(3)能证明反应已经达到平衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2V(SO3)正= V(O2)逆
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4)反应的△H
(5)反应开始到10min时SO2的平均反应速率V(SO2) =
T2时该反应的平衡常数K=
(6)一定条件下在恒温恒容的密闭容器中按一定比例充入SO2 (g)和O2 (g),平衡时SO3的体积分数随n(SO2)/n(O2) 的变化图象如图B,则A、B、C 三状态中,SO2的转化率最小的是
您最近一年使用:0次
9 . 25°C向 中滴加
中滴加 过程中,
过程中, 变化如图所示。
变化如图所示。

(1)A点溶液 ,用化学用语解释原因:
,用化学用语解释原因:_________________ 。
(2)下列有关B点溶液的说法正确的是_______________ (填字母序号)。
a. 溶质为:
b. 微粒浓度满足:
c. 微粒浓度满足:
(3) 两点水的电离程度:
两点水的电离程度:
______  (填“
(填“ ”、“
”、“  ”或“
”或“ ”)。
”)。
 中滴加
中滴加 过程中,
过程中, 变化如图所示。
变化如图所示。
(1)A点溶液
 ,用化学用语解释原因:
,用化学用语解释原因:(2)下列有关B点溶液的说法正确的是
a. 溶质为:

b. 微粒浓度满足:

c. 微粒浓度满足:

(3)
 两点水的电离程度:
两点水的电离程度:
 (填“
(填“ ”、“
”、“  ”或“
”或“ ”)。
”)。
您最近一年使用:0次
2019-03-09更新
|
307次组卷
|
2卷引用:【区级联考】北京市西城区2018-2019学年高二上学期期末考试化学试题
名校
10 . 回答下列问题:
(1)在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl— [CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是___________________________ 。
(2)二甲醚[CH3OCH3]燃料电池的工作原理如图所示.

该电池负极的电极反应式为:_______________________ 。
(3)已知在一定温度下:
C(s)+CO2(g) 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是:_____________ 。
(4)把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为__________ 。
(1)在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl—
 [CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是(2)二甲醚[CH3OCH3]燃料电池的工作原理如图所示.

该电池负极的电极反应式为:
(3)已知在一定温度下:
C(s)+CO2(g)
 2CO(g)平衡常数K;
2CO(g)平衡常数K;C(s) + H2O(g)
 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;CO(g)+H2O(g)
 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,则K、K1、K2之间的关系是:
(4)把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为
您最近一年使用:0次



