名校
解题方法
1 . 实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有________________ (任写两种)。
(2)气体X是____ ,滤渣1溶于一定浓度硫酸溶液后,加热到70~80℃可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5)n]m,则该物质中铁元素的化合价为________ 。溶液采用的加热方式为________ ,控制温度70~80℃的原因是________________ 。若溶液的pH偏小,将导致聚铁中铁的质量分数________ (填“偏高”、“偏低”或“无影响”)。
(3)加入H2O2的目的是________________ 。若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为________________ 。
(4)“一系列操作”主要包括加入足量盐酸,然后经过________________ 、过滤、洗涤,即得到氯化镁晶体。

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有
(2)气体X是
(3)加入H2O2的目的是
(4)“一系列操作”主要包括加入足量盐酸,然后经过
您最近一年使用:0次
2020-09-25更新
|
1569次组卷
|
5卷引用:山西省实验中学2021届高三9月月考化学试题
山西省实验中学2021届高三9月月考化学试题甘肃省白银市会宁县第一中学2020-2021学年高二上学期第二次月考化学试题山西省实验中学2020-2021学年高三上学期第一次月考化学试题(已下线)模拟卷04-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)江西省赣州市赣县第三中学2021-2022学年高二下学期5月月考化学试题
2014高三·全国·专题练习
名校
2 . NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:__________________________ 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
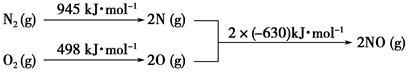
①写出该反应的热化学方程式:_______________________________ 。
②随温度升高,该反应化学平衡常数的变化趋势是____ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:______________________________
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是___________________________________________ ,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
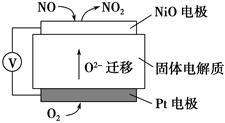
①Pt电极上发生的是________ 反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:______________________________________ 。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①写出该反应的热化学方程式:
②随温度升高,该反应化学平衡常数的变化趋势是
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
2020-09-13更新
|
1850次组卷
|
6卷引用:2014届高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷
(已下线)2014届高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(已下线)2014届高考化学二轮复习四川配套训练 第9讲非金属元素化合物练习卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷2014-2015福建省福州市第八中学高二下学期期中化学试卷步步为赢 高二化学寒假作业:综合检测(一)北京市昌平区昌平区第一中学2020届高三下学期第三次模拟考试化学试题
名校
3 . 戴口罩是防控新型冠状病毒的重要手段,口罩生产的主要原料聚丙烯由丙烯聚合而来。丙烷脱氢是丙烯工业生产的重要途径。反应的热化学方程式为C3H8(g) C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:
(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是___ 。
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是___ 、___ 。
②丙烷脱氢制丙烯反应在___ (选“高温”或“低温”)时更加容易自发进行。
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是___ 。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为___ 。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___ 。
 C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是
②丙烷脱氢制丙烯反应在
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近一年使用:0次
2020-08-28更新
|
542次组卷
|
5卷引用:专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编
(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编河南省洛阳市2020届高三第三次统一考试理综化学试题河南省洛阳市2020届高三三模化学试卷山西省大同市第一中学2021届高三上学期期中质量检测化学试题江西省吉安一中2021-2022学年高二上学期第一次段考化学试题
2020高三·全国·专题练习
解题方法
4 . 氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。在合成氨工业中,压强通常控制在20~50MP,其原因是__ 。
您最近一年使用:0次
2020高三·全国·专题练习
5 . 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+ O2(g)=NO2(g) △H=-58.2kJ·mol-1
O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见图。

①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__ 。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是__ 。
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+
 O2(g)=NO2(g) △H=-58.2kJ·mol-1
O2(g)=NO2(g) △H=-58.2kJ·mol-1SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见图。

①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是
您最近一年使用:0次
2020高三·全国·专题练习
6 . 白云石的主要成分是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2+Mg(OH)2+3CO2 CaCO3+Mg(HCO3)2+H2O。完成下列填空:
CaCO3+Mg(HCO3)2+H2O。完成下列填空:
(1)碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是___ 、___ 。温度偏低也不利于碳化反应,原因是___ 。
(2)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10min到13min之内钙离子的反应速率为___ 。15min之后钙离子浓度增大,原因是___ (用化学方程式表示)。

 CaCO3+Mg(HCO3)2+H2O。完成下列填空:
CaCO3+Mg(HCO3)2+H2O。完成下列填空:(1)碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是
(2)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10min到13min之内钙离子的反应速率为

您最近一年使用:0次
2020高三·全国·专题练习
名校
7 . 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
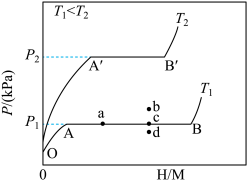
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)=ZMHy(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=___ (用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=___ mL•g-1•min。反应的焓变△H1__ 0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的___ 点(填“b”“c”或“d”),该贮氢合金可通过___ 或___ 的方式释放氢气。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。

在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)=ZMHy(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)
您最近一年使用:0次
2020-04-16更新
|
303次组卷
|
4卷引用:专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训
(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题天津市南开中学2020届高三教学质量监测理科综合化学部分新疆昌吉市第九中学2021届高三下学期开学考试化学试题
名校
8 . 随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化___ 。(选填“增大”、“减小”或“不变”)
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
a、b、c、d与m、n、x、y之间的关系式为___ 。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)已知H2的体积分数随温度升高而增加。若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化
| v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
| [CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为
您最近一年使用:0次
2020-04-16更新
|
74次组卷
|
3卷引用:专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训
(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训安徽师范大学附属中学2017-2018学年高二上学期10月月考化学试题辽宁省大连市一〇三中学2020-2021学年高二10月月考化学试题
2020高三·全国·专题练习
9 . 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___ 。增加压强,NO的转化率__ (填“提高”、“不变”或“降低”)。
②由实验结果可知,脱硫反应速率___ 脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是__ 。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
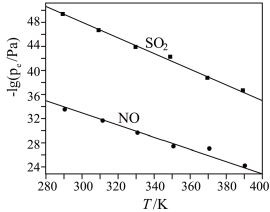
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均__ (填“增大”、“不变”或“减小”)。
②反应ClO2-+2SO32-=2SO42-+Cl-的平衡常数K表达式为___ 。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是__ 。
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②由实验结果可知,脱硫反应速率
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均
②反应ClO2-+2SO32-=2SO42-+Cl-的平衡常数K表达式为
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是
您最近一年使用:0次
2020高三·全国·专题练习
10 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式___ 。该反应需要在加压下进行,原因是___ 。
(2)298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq) AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__ (填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.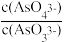 不再变化
不再变化
d.c(I-)=ymol·L-1
②tm时,v正__ v逆(填“大于”“小于”或“等于”)。
③tm时v逆___ tn时v逆(填“大于”“小于”或“等于”),理由是___ 。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___ 。
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(2)298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)
 AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.
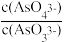 不再变化
不再变化d.c(I-)=ymol·L-1
②tm时,v正
③tm时v逆
④若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次



