名校
1 . 工业烟气、汽车尾气中的氮氧化物(NOx),可由多种方法进行脱除。
(1)采用NH3作为还原剂,可将NOx还原成N2和H2O。在某催化剂的表面,NH3和NO的反应历程势能变化如图所示(吸附在催化剂表面的物种用*标注)。
a.NH3*+NO*→NH3NO* b.NH3NO*→NH2NO*+H*
c.NH2NO*+H*→HNNOH*+H* d.HNNOH*+H*→H2O*+N2*+H*
由上图可知该反应历程的总△H___ 0(填“>”、“=”或“<”)。整个反应历程中的控速步骤为第___ 步(选填a、b、c或d),其能垒(活化能)为___ Kcal·mol-1。
(2)利用放热反应C(s)+2NO(g) CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)__ (选填a、b、c或d,下同),表示600℃条件下pCO2的是___ 。
②根据图示,列出600℃时反应平衡常数Kp的计算式__ 。(Kp等于生成物气体分压幂之积与反应物气体分压幂之积的比值)
(3)利用NaClO氧化吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而NO的脱除率如下图所示。____ (填标号)。
A.增大压强,NO的转化率增大
B.从化学平衡的角度,采用Ca(ClO)2脱硫效果优于NaClO
C.起始pH=2,脱硝效率随时间降低可能是因为ClO-+Cl-+2H+=Cl2↑+H2O
D.为提高脱硫脱硝效果,应当增大NaClO浓度、提高烟气的流速
②吸收液脱硫效果优于脱硝效果的可能原因是____ (任写一条)。
(1)采用NH3作为还原剂,可将NOx还原成N2和H2O。在某催化剂的表面,NH3和NO的反应历程势能变化如图所示(吸附在催化剂表面的物种用*标注)。

a.NH3*+NO*→NH3NO* b.NH3NO*→NH2NO*+H*
c.NH2NO*+H*→HNNOH*+H* d.HNNOH*+H*→H2O*+N2*+H*
由上图可知该反应历程的总△H
(2)利用放热反应C(s)+2NO(g)
 CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)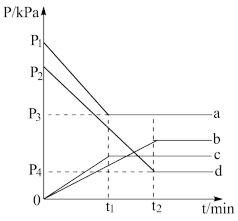
②根据图示,列出600℃时反应平衡常数Kp的计算式
(3)利用NaClO氧化吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而NO的脱除率如下图所示。

A.增大压强,NO的转化率增大
B.从化学平衡的角度,采用Ca(ClO)2脱硫效果优于NaClO
C.起始pH=2,脱硝效率随时间降低可能是因为ClO-+Cl-+2H+=Cl2↑+H2O
D.为提高脱硫脱硝效果,应当增大NaClO浓度、提高烟气的流速
②吸收液脱硫效果优于脱硝效果的可能原因是
您最近一年使用:0次
2021-03-25更新
|
293次组卷
|
2卷引用:江苏省泰州中学2019-2020学年高二下学期第二次月考化学试题
解题方法
2 . 乙烯是现代工业的重要原材料,研究工业制取乙烯有重要的意义。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1
Ⅱ.C2H6(g)+2CO2(g) 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1
反应的能量变化图如图所示:
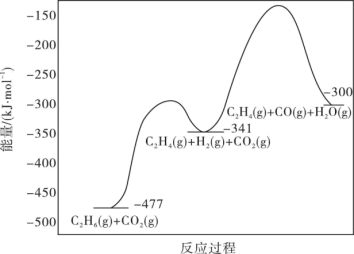
①C2H6(g)+2CO(g)+3H2(g) 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=____ kJ·mol-1
②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是___ ;一定温度和压强下,为了提高反应速率和乙烯的选择性,应当___ 。
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g) C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
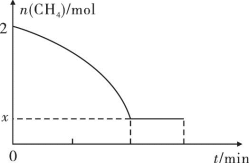
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为____ ;若将温度升高,速率常数增大的倍数:k正___ k逆(填“>”“=”或“<”)。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)
 C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1Ⅱ.C2H6(g)+2CO2(g)
 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1反应的能量变化图如图所示:

①C2H6(g)+2CO(g)+3H2(g)
 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)
 C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为
您最近一年使用:0次
2020-12-26更新
|
1505次组卷
|
3卷引用:北京市昌平区新学道临川学校2021届高三12月月考化学试题
2014高三·全国·专题练习
名校
3 . NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:__________________________ 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
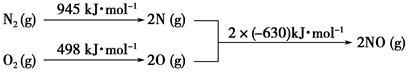
①写出该反应的热化学方程式:_______________________________ 。
②随温度升高,该反应化学平衡常数的变化趋势是____ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:______________________________
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是___________________________________________ ,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
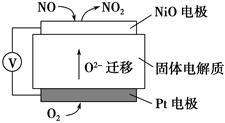
①Pt电极上发生的是________ 反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:______________________________________ 。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①写出该反应的热化学方程式:
②随温度升高,该反应化学平衡常数的变化趋势是
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
2020-09-13更新
|
1850次组卷
|
6卷引用:北京市昌平区昌平区第一中学2020届高三下学期第三次模拟考试化学试题
北京市昌平区昌平区第一中学2020届高三下学期第三次模拟考试化学试题(已下线)2014届高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(已下线)2014届高考化学二轮复习四川配套训练 第9讲非金属元素化合物练习卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷2014-2015福建省福州市第八中学高二下学期期中化学试卷步步为赢 高二化学寒假作业:综合检测(一)
名校
4 . 戴口罩是防控新型冠状病毒的重要手段,口罩生产的主要原料聚丙烯由丙烯聚合而来。丙烷脱氢是丙烯工业生产的重要途径。反应的热化学方程式为C3H8(g) C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:
(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是___ 。
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是___ 、___ 。
②丙烷脱氢制丙烯反应在___ (选“高温”或“低温”)时更加容易自发进行。
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是___ 。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为___ 。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___ 。
 C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是
②丙烷脱氢制丙烯反应在
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近一年使用:0次
2020-08-28更新
|
542次组卷
|
5卷引用:河南省洛阳市2020届高三第三次统一考试理综化学试题
河南省洛阳市2020届高三第三次统一考试理综化学试题河南省洛阳市2020届高三三模化学试卷(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编山西省大同市第一中学2021届高三上学期期中质量检测化学试题江西省吉安一中2021-2022学年高二上学期第一次段考化学试题
名校
解题方法
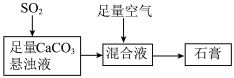
5 . 下图表示的是生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO2发生反应的原因______ 。

您最近一年使用:0次
6 . 铜冶金术以火法治为主,炼铜的副产品SO2多用于制硫酸和石背等化学产品。火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)→2Cu2O(s)+2SO2(g)+768.2kJ
反应II:2Cu2O(s)+Cu2S(s)→6Cu(s)+SO2(g)-116.0kJ
(1)在反应Ⅱ中,每生成1mol SO2转移电子_______ mol,反应Cu2S(s)+O2(g)→2Cu(s)+SO2(g)+Q的Q=_____ kJ。
(2)理论上m1:m2=_________ 。

反应I:2Cu2S(s)+3O2(g)→2Cu2O(s)+2SO2(g)+768.2kJ
反应II:2Cu2O(s)+Cu2S(s)→6Cu(s)+SO2(g)-116.0kJ
(1)在反应Ⅱ中,每生成1mol SO2转移电子
(2)理论上m1:m2=
您最近一年使用:0次
解题方法
7 . 有效控制大气温室气体浓度,推动绿色低碳发展,是人类可持续发展的重要战略之一,因此捕集、利用CO2始终是科学研究的热点。
(1)新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。
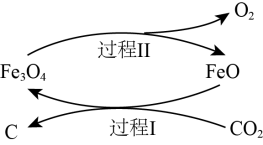
①碳在元素周期表中的位置是_______________ 。
②整个过程中FeO的作用是__________________ 。
③写出CO2转化为炭黑的总反应化学方程式__________________ 。
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
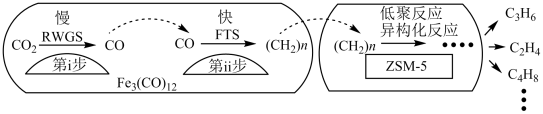
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________ 助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________ 。
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。
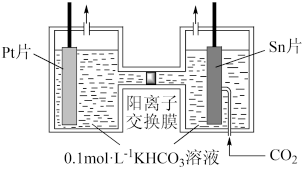
①写出阴极CO2还原为HCOO−的电极反应式:________________________ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____________________ 。
(1)新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。

①碳在元素周期表中的位置是
②整个过程中FeO的作用是
③写出CO2转化为炭黑的总反应化学方程式
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率 (%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加
②加入助剂能提高单位时间内乙烯产量的根本原因是
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。

①写出阴极CO2还原为HCOO−的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
您最近一年使用:0次
解题方法
8 . 现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(1) CH3OH(1)+
CH3OH(1)+ O2(g) △H=+727kJ·mol-1△G=+703kJ·mol-1
O2(g) △H=+727kJ·mol-1△G=+703kJ·mol-1
②CO2(g)+2H2O(1) CH4(g)+2O2(g) △H=+890kJ·mol-1△G=+818kJ·mol-1
CH4(g)+2O2(g) △H=+890kJ·mol-1△G=+818kJ·mol-1
③CO2(g)+3H2(g) CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
④CO2(g)+4H2(g) CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是____ ,反应进行程度最大的是_____ 。
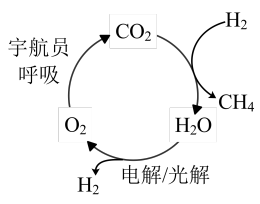
(2)反应CO2(g)+4H2(g)=CH4(g) +2H2O(g)称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充_________ (填化学式)。
②在1.5 MPa,气体流速为20 mL·min-l时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
分析上表数据可知:_____ (填化学式)的催化性能更好。
③调整气体流速,研究其对某一催化剂催化效率的影响,得到CO2的转化率(%)如下:
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率____ (填“增大”或“减小”),其可能的原因是_________________________________ 。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是____ ,已知初始反应气体中V(H2):V(CO2) =4:l,估算该温度下的平衡常数为 ___________ (列出计算表达式)。
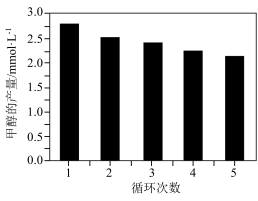
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因_________________________________ 。(已知Co的性质与Fe相似)
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(1)
 CH3OH(1)+
CH3OH(1)+ O2(g) △H=+727kJ·mol-1△G=+703kJ·mol-1
O2(g) △H=+727kJ·mol-1△G=+703kJ·mol-1②CO2(g)+2H2O(1)
 CH4(g)+2O2(g) △H=+890kJ·mol-1△G=+818kJ·mol-1
CH4(g)+2O2(g) △H=+890kJ·mol-1△G=+818kJ·mol-1③CO2(g)+3H2(g)
 CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1④CO2(g)+4H2(g)
 CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1从化学平衡的角度来看,上述化学反应中反应进行程度最小的是
(2)反应CO2(g)+4H2(g)=CH4(g) +2H2O(g)称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充

②在1.5 MPa,气体流速为20 mL·min-l时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
| 催化剂 | 180°C | 200°C | 220°C | 280°C | 300°C | 320°C | 340°C | 360°C |
| Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 86.8 | 90.1 |
| Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:
③调整气体流速,研究其对某一催化剂催化效率的影响,得到CO2的转化率(%)如下:
| 气体速度/mL·min-1 | 180°C | 200°C | 220°C | 280°C | 300°C | 320°C | 340°C | 360°C |
| 10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
| 30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
| 40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
| 50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因

您最近一年使用:0次
2020高三·全国·专题练习
名校
9 . 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
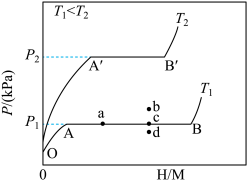
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)=ZMHy(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=___ (用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=___ mL•g-1•min。反应的焓变△H1__ 0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的___ 点(填“b”“c”或“d”),该贮氢合金可通过___ 或___ 的方式释放氢气。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。

在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)=ZMHy(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)
您最近一年使用:0次
2020-04-16更新
|
303次组卷
|
4卷引用:广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题
广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题天津市南开中学2020届高三教学质量监测理科综合化学部分(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训新疆昌吉市第九中学2021届高三下学期开学考试化学试题
解题方法
10 . 建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOX)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
(1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) ∆H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ∆H2=-574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) ∆H3=-1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是___ 。
(2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:
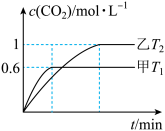
①甲容器中,平衡时NO2的转化率为____ ;
②T1___ T2(填“>”或“<”);△H___ 0(填“>”或“<”),判定的依据是____ ;
③T2温度时,该反应的平衡常数K=____ ;
④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)___ v(逆)(填“>”“<”或“=”)。
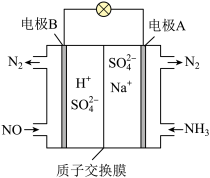
(3)方案3:可以利用原电池原理处理氮氧化合物,原理如图。则其正极的电极反应式为____ 。
(1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) ∆H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ∆H2=-574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) ∆H3=-1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是
(2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:

①甲容器中,平衡时NO2的转化率为
②T1
③T2温度时,该反应的平衡常数K=
④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)
(3)方案3:可以利用原电池原理处理氮氧化合物,原理如图。则其正极的电极反应式为

您最近一年使用:0次



