解题方法
1 . 下列反应,其自由能在一定 范围符合给出的关 系式:
(I)2NaHCO3(s) = Na2CO3(g)+ H2O(g)+ CO2(g)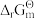 =[129076- 334.2T/K]J· mol-1
=[129076- 334.2T/K]J· mol-1
(II)NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g)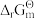 =[171502 - 476.4 T/K]J· mol-1
=[171502 - 476.4 T/K]J· mol-1
以下问题中与上述反应相关的自由能,均可由上述条件式计算,所有分压均须以p 表示。
表示。
(1)计算在 298K时,当NaHCO3(s), Na2CO3(s)和NH4HCO3(s)平衡共存时氨的分压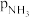
________ 。
(2)将NaHCO3(s), Na2CO3(s)和NH4HCO3(s)放入一个真空容器中平衡后,体系的独立组分数K,相数Φ和自由度f各为多少________ 、________ 、________ ?
(3) 计算当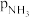 =
= 时,NH4HCO3(s), Na2CO3(s)和NaHCO3(s)平街共存的温度
时,NH4HCO3(s), Na2CO3(s)和NaHCO3(s)平街共存的温度________ 。
(4)在298K时,将Na2CO3(s), NaHCO3(s)和NH4HCO3(s)共同置于密闭容器中,使NH4HCO3(s)免受更多的分解,这种设想能否实现________ ?请用热力学原理计算说明________ 。
(5)在373K,p 条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s), 计算:为避免NaHCO3(s)分解,气流中水的摩尔分数
条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s), 计算:为避免NaHCO3(s)分解,气流中水的摩尔分数________ 。
(6)CO2(g)是温室气体, 焙烧CaCO3(s)时产生过程有两种:
①CaCO3(s)热分解制生石灰,不同温度下的分解压力即CO2的平衡压力示于下表。由CaCO3(s)烧制生石灰时, 若窑中气体不与外界对流,则窑温至少应维持多少度________ ?
②用焦炭作燃料产生CO2:若通入空气的量恰好能使其中的O2完全转化为CO2,燃烧后的气体从窑顶逸出,欲使CaCO3(s)不断分解,窑的温度最低维持多少________ ? (设空气体积分数为21.0% O2和79.0% N2,每种气体均看作理想气体)
(I)2NaHCO3(s) = Na2CO3(g)+ H2O(g)+ CO2(g)
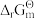 =[129076- 334.2T/K]J· mol-1
=[129076- 334.2T/K]J· mol-1(II)NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g)
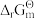 =[171502 - 476.4 T/K]J· mol-1
=[171502 - 476.4 T/K]J· mol-1以下问题中与上述反应相关的自由能,均可由上述条件式计算,所有分压均须以p
 表示。
表示。(1)计算在 298K时,当NaHCO3(s), Na2CO3(s)和NH4HCO3(s)平衡共存时氨的分压
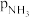
(2)将NaHCO3(s), Na2CO3(s)和NH4HCO3(s)放入一个真空容器中平衡后,体系的独立组分数K,相数Φ和自由度f各为多少
(3) 计算当
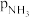 =
= 时,NH4HCO3(s), Na2CO3(s)和NaHCO3(s)平街共存的温度
时,NH4HCO3(s), Na2CO3(s)和NaHCO3(s)平街共存的温度(4)在298K时,将Na2CO3(s), NaHCO3(s)和NH4HCO3(s)共同置于密闭容器中,使NH4HCO3(s)免受更多的分解,这种设想能否实现
(5)在373K,p
 条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s), 计算:为避免NaHCO3(s)分解,气流中水的摩尔分数
条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s), 计算:为避免NaHCO3(s)分解,气流中水的摩尔分数(6)CO2(g)是温室气体, 焙烧CaCO3(s)时产生过程有两种:
①CaCO3(s)热分解制生石灰,不同温度下的分解压力即CO2的平衡压力示于下表。由CaCO3(s)烧制生石灰时, 若窑中气体不与外界对流,则窑温至少应维持多少度
| t/℃ | 600 | 795 | 840 | 880 | 896 | 910 |
p/ p | 0.0132 | 0.210 | 0.421 | 0.763 | 1.00 | 1.32 |
②用焦炭作燃料产生CO2:若通入空气的量恰好能使其中的O2完全转化为CO2,燃烧后的气体从窑顶逸出,欲使CaCO3(s)不断分解,窑的温度最低维持多少
您最近一年使用:0次
解题方法
2 . 乙烯是现代工业的重要原材料,研究工业制取乙烯有重要的意义。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1
Ⅱ.C2H6(g)+2CO2(g) 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1
反应的能量变化图如图所示:
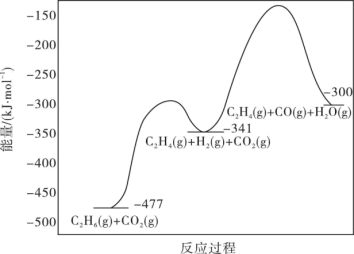
①C2H6(g)+2CO(g)+3H2(g) 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=____ kJ·mol-1
②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是___ ;一定温度和压强下,为了提高反应速率和乙烯的选择性,应当___ 。
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g) C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
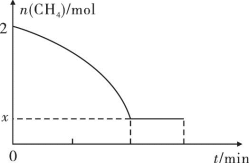
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为____ ;若将温度升高,速率常数增大的倍数:k正___ k逆(填“>”“=”或“<”)。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)
 C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1Ⅱ.C2H6(g)+2CO2(g)
 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1反应的能量变化图如图所示:

①C2H6(g)+2CO(g)+3H2(g)
 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)
 C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为
您最近一年使用:0次
2020-12-26更新
|
1508次组卷
|
3卷引用:北京市昌平区新学道临川学校2021届高三12月月考化学试题
3 . 煤和天然气都是重要的化石资源,在工业生产中用途广泛。
(1)燃煤时往往在煤中添加石灰石,目的是_______ ,达到该目的时发生反应的化学方程式为____________ 。
(2)煤的综合利用包括________ (将煤隔绝空气加强热)、煤的气化和液化。煤的气化是将其转化为可燃性气体的过程,主要发生的反应的化学方程式为_________ 。
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S_____ (填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为_____ 。
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。
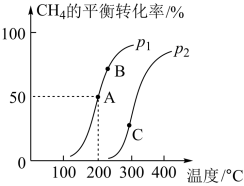
①200 °C时,该反应的平衡常数K=__________ 。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是_________ 。
③压强:p1___________ (填“>”“<”或“=”)p2。
(1)燃煤时往往在煤中添加石灰石,目的是
(2)煤的综合利用包括
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
| 温度/°C | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。

①200 °C时,该反应的平衡常数K=
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③压强:p1
您最近一年使用:0次
2014高三·全国·专题练习
名校
4 . NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:__________________________ 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
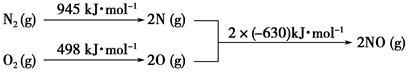
①写出该反应的热化学方程式:_______________________________ 。
②随温度升高,该反应化学平衡常数的变化趋势是____ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:______________________________
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是___________________________________________ ,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
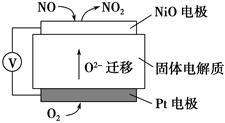
①Pt电极上发生的是________ 反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:______________________________________ 。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①写出该反应的热化学方程式:
②随温度升高,该反应化学平衡常数的变化趋势是
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
2020-09-13更新
|
1854次组卷
|
6卷引用:2014届高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷
(已下线)2014届高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(已下线)2014届高考化学二轮复习四川配套训练 第9讲非金属元素化合物练习卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷2014-2015福建省福州市第八中学高二下学期期中化学试卷步步为赢 高二化学寒假作业:综合检测(一)北京市昌平区昌平区第一中学2020届高三下学期第三次模拟考试化学试题
2020高三·全国·专题练习
5 . 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___ 。增加压强,NO的转化率__ (填“提高”、“不变”或“降低”)。
②由实验结果可知,脱硫反应速率___ 脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是__ 。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
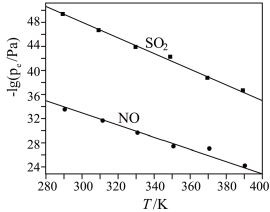
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均__ (填“增大”、“不变”或“减小”)。
②反应ClO2-+2SO32-=2SO42-+Cl-的平衡常数K表达式为___ 。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是__ 。
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②由实验结果可知,脱硫反应速率
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均
②反应ClO2-+2SO32-=2SO42-+Cl-的平衡常数K表达式为
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是
您最近一年使用:0次
名校
解题方法
6 . 以NOx 为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2 和 CO2:
(1)已知:①N2(g)+O2(g) 2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)
2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g) N2(g)+2CO2(g) △H3 =
N2(g)+2CO2(g) △H3 =_______ 。
(2)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应③ 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
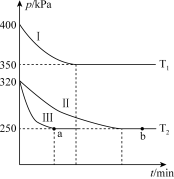
①温度:T1_____ T2(填“<”“=”或“>”)。
②CO 的平衡转化率:Ⅰ_____ Ⅱ_____ Ⅲ(填“<”“=”或“>”)。
③反应速率:a 点的 v逆_____ b 点的 v正 (填“<”“=”或“>”)。
④T2 时的平衡常数 Kc=_____ 。
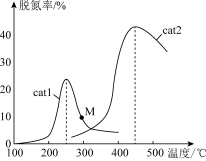
(3)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图所示。M 点_____ (填“是”或“不是”)对应温度下的平衡脱氮率, 说明理由_________ 。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应 2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高 N2O 的分解速率,反应历程为:
第一步 I2(g) 2I(g)快速平衡,平衡常数为K
2I(g)快速平衡,平衡常数为K
第二步 I(g)+N2O(g)→N2(g)+IO(g) v = k1·c(N2O)·c(I) 慢反应
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+1/2I2(g) 快反应
其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
① k =_____ (用含 K 和 k1 的代数式表示)。
②下列表述正确的是_____ 。
a.IO 为反应的中间产物
b.碘蒸气的浓度大小不会影响 N2O的分解速率
c.第二步对总反应速率起决定作用
d.催化剂会降低反应的活化能,从而影响△H
(5)通过 N2O 传感器可监测环境中 N2O 的含量,其工作原理如图所示
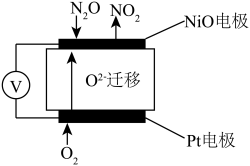
①NiO电极上的电极反应式为_____ 。
②N2O浓度越高,则电压表读数越_____ 。(填“高”或“低”)
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2 和 CO2:
(1)已知:①N2(g)+O2(g)
 2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)
2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g) N2(g)+2CO2(g) △H3 =
N2(g)+2CO2(g) △H3 =(2)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应③ 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:

①温度:T1
②CO 的平衡转化率:Ⅰ
③反应速率:a 点的 v逆
④T2 时的平衡常数 Kc=
(3)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图所示。M 点

Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应 2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高 N2O 的分解速率,反应历程为:
第一步 I2(g)
 2I(g)快速平衡,平衡常数为K
2I(g)快速平衡,平衡常数为K第二步 I(g)+N2O(g)→N2(g)+IO(g) v = k1·c(N2O)·c(I) 慢反应
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+1/2I2(g) 快反应
其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
① k =
②下列表述正确的是
a.IO 为反应的中间产物
b.碘蒸气的浓度大小不会影响 N2O的分解速率
c.第二步对总反应速率起决定作用
d.催化剂会降低反应的活化能,从而影响△H
(5)通过 N2O 传感器可监测环境中 N2O 的含量,其工作原理如图所示

①NiO电极上的电极反应式为
②N2O浓度越高,则电压表读数越
您最近一年使用:0次
2014·上海奉贤·二模
7 . 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有_______________ (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) + Q1 2NO(g)+O2(g)
2SO3(g) + Q1 2NO(g)+O2(g)  2NO2(g) + Q2
2NO2(g) + Q2
则SO2(g)+NO2(g) SO3(g)+NO(g)+ Q3 , Q3=
SO3(g)+NO(g)+ Q3 , Q3=_________ kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是____ (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
(3)矿石燃料的燃烧是造成酸雨的主要因素之一 。而甲醇日趋成为重要的有机燃料,通常利用CO和H2 合成甲醇,其反应的化学方程式为CO(g)+ 2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
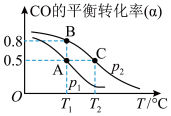
①上述合成甲醇的反应为________ 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_____________________ 。
(1)上述3种气体直接排入空气后会引起酸雨的气体有
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:SO2(g)+NO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)①若已知2SO2(g)+O2(g)
 2SO3(g) + Q1 2NO(g)+O2(g)
2SO3(g) + Q1 2NO(g)+O2(g)  2NO2(g) + Q2
2NO2(g) + Q2则SO2(g)+NO2(g)
 SO3(g)+NO(g)+ Q3 , Q3=
SO3(g)+NO(g)+ Q3 , Q3=②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g)
 SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
(3)矿石燃料的燃烧是造成酸雨的主要因素之一 。而甲醇日趋成为重要的有机燃料,通常利用CO和H2 合成甲醇,其反应的化学方程式为CO(g)+ 2H2(g)
 CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为
②A、B、C三点的平衡常数KA、KB、KC的大小关系为
您最近一年使用:0次
名校
8 . 石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为___ 。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为___ 。(已知H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为___ 。
(4)COS的水解反应为COS(g)+H2O(g) CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
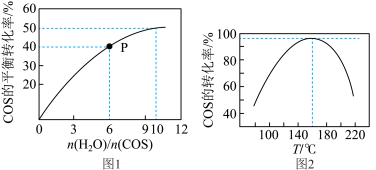
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]=___ ,温度___ 。
②P点对应的平衡常数为___ 。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是___ 。
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为
(3)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为
(4)COS的水解反应为COS(g)+H2O(g)
 CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]=
②P点对应的平衡常数为
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是
您最近一年使用:0次
9 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___ 。
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___ mol•L-1•min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
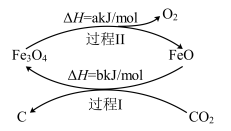
①在转化过程中起催化作用的物质是___ ;
②写出总反应的化学方程式___ 。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H___ 0。(填“>”、“<”或“=”);
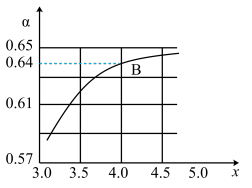
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___ ;B点处,NH3的平衡转化率为___ 。
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)
 C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g)
 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的
 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
您最近一年使用:0次
2019-12-06更新
|
709次组卷
|
6卷引用:吉林省吉林市普通高中2020届高三上学期第一次调研测试化学试题
18-19高二·浙江·期中
名校
解题方法
10 .  (主要指NO和
(主要指NO和 )是大气主要污染物之一。有效去除大气中的
)是大气主要污染物之一。有效去除大气中的 ,是环境保护的重要课题。
,是环境保护的重要课题。
(1)用稀硝酸吸收 ,得到
,得到 和
和 的混合溶液,惰性电极电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
的混合溶液,惰性电极电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:______________________________________ 。
(2)在有氧条件下,新型催化剂M能催化 与
与 反应生成
反应生成 。
。
①写出 与
与 反应方程式
反应方程式__________________________________________ 。
②将一定比例的 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(如图-1所示)
的混合气体,匀速通入装有催化剂M的反应器中反应(如图-1所示)
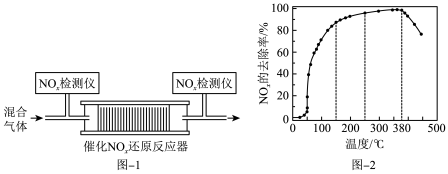
反应相同时间 的去除率随反应温度的变化曲线如图-2所示,在50~150℃范围内随着温度的升高,
的去除率随反应温度的变化曲线如图-2所示,在50~150℃范围内随着温度的升高, 的去除率迅速上升的主要原因是
的去除率迅速上升的主要原因是_____________________________ ,150~380℃范围 的去除率上升缓慢的主要原因是
的去除率上升缓慢的主要原因是_____________________________ 。当反应温度高于380℃时, 的去除率迅速下降的原因可能是:
的去除率迅速下降的原因可能是:_____________________________ ;_____________________________ 。
 (主要指NO和
(主要指NO和 )是大气主要污染物之一。有效去除大气中的
)是大气主要污染物之一。有效去除大气中的 ,是环境保护的重要课题。
,是环境保护的重要课题。(1)用稀硝酸吸收
 ,得到
,得到 和
和 的混合溶液,惰性电极电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
的混合溶液,惰性电极电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:(2)在有氧条件下,新型催化剂M能催化
 与
与 反应生成
反应生成 。
。①写出
 与
与 反应方程式
反应方程式②将一定比例的
 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(如图-1所示)
的混合气体,匀速通入装有催化剂M的反应器中反应(如图-1所示)
反应相同时间
 的去除率随反应温度的变化曲线如图-2所示,在50~150℃范围内随着温度的升高,
的去除率随反应温度的变化曲线如图-2所示,在50~150℃范围内随着温度的升高, 的去除率迅速上升的主要原因是
的去除率迅速上升的主要原因是 的去除率上升缓慢的主要原因是
的去除率上升缓慢的主要原因是 的去除率迅速下降的原因可能是:
的去除率迅速下降的原因可能是:
您最近一年使用:0次



