1 . 研究硫元素及其化合物的性质具有重要意义。
Ⅰ.已知I-可以催化二氧化硫与水溶液中发生的歧化反应:
3SO2(g)+2H2O(l) =2H2SO4(aq)+ S(s) △H<0,催化原理分为两步,
第一步反应为吸热的慢反应:SO2 + 4I-+ 4H+ = 2H2O + S↓+ 2I2
第二步反应为放热的快反应:2H2O + I2 +________ = ________ +________ + 2I-
(1)请补充第二步反应
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为_______________
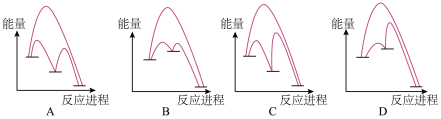
Ⅱ. 工业制硫酸,在接触室发生反应2SO2(g) +O2(g) 2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:

(3)能证明反应已经达到平衡状态的是________________
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2V(SO3)正= V(O2)逆
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4)反应的△H____________ 0(填“>”“<”或“=”)
(5)反应开始到10min时SO2的平均反应速率V(SO2) =_____________ mol/(L.min).
T2时该反应的平衡常数K=________________
(6)一定条件下在恒温恒容的密闭容器中按一定比例充入SO2 (g)和O2 (g),平衡时SO3的体积分数随n(SO2)/n(O2) 的变化图象如图B,则A、B、C 三状态中,SO2的转化率最小的是______________ 点,当n(SO2)/n(O2) =3 时,达到平衡状态SO3的体积分数可能是D、E、F三点中的_____ 点
Ⅰ.已知I-可以催化二氧化硫与水溶液中发生的歧化反应:
3SO2(g)+2H2O(l) =2H2SO4(aq)+ S(s) △H<0,催化原理分为两步,
第一步反应为吸热的慢反应:SO2 + 4I-+ 4H+ = 2H2O + S↓+ 2I2
第二步反应为放热的快反应:2H2O + I2 +
(1)请补充第二步反应
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为

Ⅱ. 工业制硫酸,在接触室发生反应2SO2(g) +O2(g)
 2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
(3)能证明反应已经达到平衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2V(SO3)正= V(O2)逆
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4)反应的△H
(5)反应开始到10min时SO2的平均反应速率V(SO2) =
T2时该反应的平衡常数K=
(6)一定条件下在恒温恒容的密闭容器中按一定比例充入SO2 (g)和O2 (g),平衡时SO3的体积分数随n(SO2)/n(O2) 的变化图象如图B,则A、B、C 三状态中,SO2的转化率最小的是
您最近一年使用:0次
名校
解题方法
2 . 醋酸和一水合氨是中学化学中常见的弱电解质。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是_______ (填序号)
①配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质。
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质。
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质。
④配制一定量的CH3COONa溶液,测其pH,若pH大于7,则证明醋酸为弱电解质。
(2)若25℃时,0.10 mol/L的CH3COOH的电离度为1%,则该溶液的pH=________ ,由醋酸电离出的c(H+)约为水电离出的c(H+)的_________ 倍。
(3)已知在25℃时,醋酸的电离平衡常数为Ka=1.8×10-5。常温下,0.1mol/L NaOH溶液V1 mL和0.2mol/L CH3COOH溶液V2 mL混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
①反应后溶液中离子浓度的大小关系为_________________________________________________ 。
②V1:V2__________ (填“>”、“<”或“=”)2:1
③c(CH3COO-):c(CH3COOH)=__________________ 。
(4)常温下,可用氨水吸收废气中的CO2得到NH4HCO3溶液,在该溶液中,c(NH4+)_______ (填“>”、“<”或“=”)c(HCO3-);反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=_________ 。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是
①配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质。
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质。
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质。
④配制一定量的CH3COONa溶液,测其pH,若pH大于7,则证明醋酸为弱电解质。
(2)若25℃时,0.10 mol/L的CH3COOH的电离度为1%,则该溶液的pH=
(3)已知在25℃时,醋酸的电离平衡常数为Ka=1.8×10-5。常温下,0.1mol/L NaOH溶液V1 mL和0.2mol/L CH3COOH溶液V2 mL混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
①反应后溶液中离子浓度的大小关系为
②V1:V2
③c(CH3COO-):c(CH3COOH)=
(4)常温下,可用氨水吸收废气中的CO2得到NH4HCO3溶液,在该溶液中,c(NH4+)
 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
3 . 目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:___________ ;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
①实验2条件下的H2O 体积分数为___________ ;
②下列方法中可以证明上述已达平衡状态的是___________ ;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=___________ 。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式___________ 。
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,
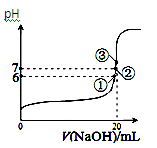
下列说法正确的是___________ 。
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO-)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:

①写出A极发生的电极反应式___________ ;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与___________ 极(填“C”或“D”)相连。
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验2条件下的H2O 体积分数为
②下列方法中可以证明上述已达平衡状态的是
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)
 CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,

下列说法正确的是
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO-)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:

①写出A极发生的电极反应式
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
您最近一年使用:0次
名校
4 . (1)现有下列11种物质:
①纯碱②Mn2O7③硫酸④CaO⑤CO2⑥Na2CO3
⑦CuSO4·5H2O⑧SO2⑨Na2O2⑩CO⑪NO2
其中属于正盐的是______________ ;属于酸性氧化物的是__________________ 。
(2)有关胶体的实验中:
①实验室制备Fe(OH)3胶体的化学方程式为_________
②将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极负极橘红色加深,证明Sb2S3胶粒带______ (填“正”或“负”)电荷。
①纯碱②Mn2O7③硫酸④CaO⑤CO2⑥Na2CO3
⑦CuSO4·5H2O⑧SO2⑨Na2O2⑩CO⑪NO2
其中属于正盐的是
(2)有关胶体的实验中:
①实验室制备Fe(OH)3胶体的化学方程式为
②将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极负极橘红色加深,证明Sb2S3胶粒带
您最近一年使用:0次
5 . 醋酸是实验室及生活中的常见物质。
(1)写出醋酸的电离方程式______________ 。
(2)常温下醋酸溶液的pH <7,用文字描述其原因是____________ 。
(3)能证明醋酸是弱 酸的实验事实是(多选、错选不得分)_________ 。
a.同浓度的CH3COOH溶液和盐酸分别与相同的Mg条反应,放出H2的初始速率醋酸慢
b.0.1 mol·L-1 CH3COONa溶液的pH> 7
c.CH3COOH溶液与Na2CO3反应生成CO2
d.0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红
e. 常温下0.1mol/l醋酸溶液的pH>1

ⅰ.当加入NaOH溶液20 ml时,①溶液的离子浓度大小关系是____________ 。
ⅱ.当②溶液的pH=7时,溶液中存在的微粒浓度大小关系正确的是____________ 。
a.c(Na+)=c(Ac-)>c(HAc)>c(H+)=c(OH-)
b.c(Na+)=c(Ac-)>c(H+)=c(OH-)>c(HAc)
c.c(HAc)>c(Na+)=c(Ac-)>c(H+)=c(OH-)
(1)写出醋酸的电离方程式
(2)常温下醋酸溶液的pH <7,用文字描述其原因是
(3)能证明醋酸是
a.同浓度的CH3COOH溶液和盐酸分别与相同的Mg条反应,放出H2的初始速率醋酸慢
b.0.1 mol·L-1 CH3COONa溶液的pH> 7
c.CH3COOH溶液与Na2CO3反应生成CO2
d.0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红
e. 常温下0.1mol/l醋酸溶液的pH>1
(4)25 ℃时,在体积均为20 mL、浓度均为0.1 mol·L-1的CH3COOH、HCl溶液中,分别逐滴加入浓度为0.1 mol·L-1的NaOH溶液,溶液pH随加入NaOH溶液体积变化如图所示。

ⅰ.当加入NaOH溶液20 ml时,①溶液的离子浓度大小关系是
ⅱ.当②溶液的pH=7时,溶液中存在的微粒浓度大小关系正确的是
a.c(Na+)=c(Ac-)>c(HAc)>c(H+)=c(OH-)
b.c(Na+)=c(Ac-)>c(H+)=c(OH-)>c(HAc)
c.c(HAc)>c(Na+)=c(Ac-)>c(H+)=c(OH-)
您最近一年使用:0次
6 . 氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。氰化钠同时也是一种剧毒物质,严重危害人类健康,一旦泄漏需要及时处理。
(1)①已知:25℃时,HCN的电离平衡常数Ka=6.2×10-10,H2CO3的电离平衡常数是Ka1=4.5×10-7、Ka2=4.7×10-11。向NaCN溶液通入少量CO2的化学反应方程式是:_____________ 。
②NaCN 的电子式为__________ ,其中元素的非金属性N___ C(填“>”“<”或“=”),请设计实验证明:______________________ 。
(2)氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
①常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。该反应的化学方程式是:__________________ 。
②已知:氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3=NaSCN+Na2SO3。则硫氰化钠中碳的化合价为______ ;写出硫氰化钠的一种用途________ (用离子方程式表示)。
(3)某化学小组检测某含氰化钠的废水中CN-的浓度。实验如下:
①取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂;
②用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50ml;
滴定时, 1.000×10-4mol/L的标准AgNO3溶液应用_____ (填仪器名称)盛装;滴定终点时的现象是______ (已知:Ag++2CN-=[Ag(CN)2]-(无色溶液),Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。)
(1)①已知:25℃时,HCN的电离平衡常数Ka=6.2×10-10,H2CO3的电离平衡常数是Ka1=4.5×10-7、Ka2=4.7×10-11。向NaCN溶液通入少量CO2的化学反应方程式是:
②NaCN 的电子式为
(2)氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
①常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。该反应的化学方程式是:
②已知:氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3=NaSCN+Na2SO3。则硫氰化钠中碳的化合价为
(3)某化学小组检测某含氰化钠的废水中CN-的浓度。实验如下:
①取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂;
②用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50ml;
滴定时, 1.000×10-4mol/L的标准AgNO3溶液应用
您最近一年使用:0次
名校
解题方法
7 . 化学反应原理对学习化学有重要的指导作用。某学习小组特邀你参与下列探究:
(1)影响化学平衡移动因素的探究:在NH4Cl 溶液中存在如下平衡:NH4Cl + H2O NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
①写出该反应的平衡常数表达式:____________________________ 。
②有同学认为,上表中在“条件改变”一栏除列举的4种之外,还添加一种就更为完美,你认为最好添加哪一种“改变条件”?_____________ ;
③“学习之道在于悟”,结合NH4Cl与水反应的方程式和影响平衡移动的因素分析:加水稀释对上述平衡的影响类似于_____________ 。
A.使用催化剂对化学平衡的影响; B.减小生成物浓度对化学平衡的影响;
C.升高温度对化学平衡的影响; D.减小压强对化学平衡的影响
(2)复分解反应进行的方向的探究
【提出问题】为什么只要有难溶物质、弱电解质、易挥发的物质生成复分解反应型离子反应就可以发生?
【分析解决问题】小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对上述问题作出合理解释:生成难溶物质、弱电解质、易挥发的物质时将会导致体系的_______________ 或者__________________ 。
(3)反应条件(介质环境)的探究
已知I- 能被O2氧化生成I2,为探究反应条件(介质环境)设计了如下方案:
①上述实验证明,该实验不能选择在中性或者碱性条件下进行,为什么?_____________ ;
②写出第三组实验中发生反应的离子方程式_____________ ;
(1)影响化学平衡移动因素的探究:在NH4Cl 溶液中存在如下平衡:NH4Cl + H2O
 NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:| 改变条件 | 适当升高温度 | 加水稀释 | 通入HCl(g) | 加少量NaOH固体 |
| 平衡移动方向 | 无需填写 | 正向 | 逆向 | 正向 |
①写出该反应的平衡常数表达式:
②有同学认为,上表中在“条件改变”一栏除列举的4种之外,还添加一种就更为完美,你认为最好添加哪一种“改变条件”?
③“学习之道在于悟”,结合NH4Cl与水反应的方程式和影响平衡移动的因素分析:加水稀释对上述平衡的影响类似于
A.使用催化剂对化学平衡的影响; B.减小生成物浓度对化学平衡的影响;
C.升高温度对化学平衡的影响; D.减小压强对化学平衡的影响
(2)复分解反应进行的方向的探究
【提出问题】为什么只要有难溶物质、弱电解质、易挥发的物质生成复分解反应型离子反应就可以发生?
【分析解决问题】小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对上述问题作出合理解释:生成难溶物质、弱电解质、易挥发的物质时将会导致体系的
(3)反应条件(介质环境)的探究
已知I- 能被O2氧化生成I2,为探究反应条件(介质环境)设计了如下方案:
| 操作 | 现象 | |
| 第一组 | 向2mL1mol/LKI溶液中滴加几滴淀粉溶液 | 未出现蓝色 |
| 第二组 | 向2mL1mol/LKI溶液中滴加2mL1mol/LNaOH溶液再滴加几滴淀粉溶液 | 未出现蓝色 |
| 第三组 | 向2mL1mol/LKI溶液中滴加2mL1mol/LH2SO4溶液再滴加几滴淀粉溶液 | 溶液变蓝 |
①上述实验证明,该实验不能选择在中性或者碱性条件下进行,为什么?
②写出第三组实验中发生反应的离子方程式
您最近一年使用:0次
名校
8 . 锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量 SiO2)制备锑白的工艺流程如下图:

已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是_________ (任写一种)。请写出其中发生的氧化还原反应离子方程式: _________ 。滤渣的成分为S单质和_________ 。
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________ 。
(3) 简述检验沉淀是否洗净的实验方法:_________ ,若未出现浑浊则证明沉淀已洗干净,反之则没有。

已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O
 Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):(3) 简述检验沉淀是否洗净的实验方法:
您最近一年使用:0次
2017-08-26更新
|
226次组卷
|
2卷引用:江西省南昌市2018届高三摸底调研考试化学试题
9 . (1)硫元素位于元素周期表第____ 列;硫元素原子核外有2个未成对电子,这2个电子所处亚层的符号是_______ ;硫、氯元素的原子均可形成与Ar原子电子层结构相同的简单离子,且硫离子的半径更大,请解释__________________ 。
(2)S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有___ 个S-S键;已知:H-S键键能:339 kJ/mol;H-Se键键能:314 kJ/mol。以上键能数据能否比较S、Se非金属性的强弱______ (选填“能”、“否”;下同);能否比较H2S、H2Se沸点的高低______ 。
(3)在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此判断NaHSO3溶液显___ 性。
(4)在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32-)=c (HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)___________ 。
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)已知Na2SO3溶液中存在水解平衡:SO32-+H2O HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是__________ ,操作和现象是__________________ 。
(2)S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有
(3)在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此判断NaHSO3溶液显
(4)在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32-)=c (HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)已知Na2SO3溶液中存在水解平衡:SO32-+H2O
 HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是
您最近一年使用:0次
2017-04-06更新
|
176次组卷
|
3卷引用:2015届上海市静安、青浦、宝山区高三下学期二模化学试卷
名校
10 . “2015·8·12”天津港爆炸中有一定量的氰化物泄漏。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
(1)根据价键规则,写出H2CO3的结构式__________ 。
(2)下列能用于判断氮、碳两种元素非金属性强弱的是_________ (填序号)
a.气态氢化物的稳定性强弱b.最高价氧化物对应水化物酸性强弱
c. Al2O3+N2+3C=2AlN+3CO d.比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因_______ 。请判断该溶液中:c(CN-)__ c(OH-)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-。CNO-在酸性条件下继续被NaClO氧化生成N2与CO2。某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率。

将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为___________ ,乙中反应的离子方程式为________ 。
②上述实验是通过测定CO2的量来确定CN-的处理效果。若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是__________ ,戊中盛有足量的石灰水,若实验后戊中生成0.9g沉淀,则CN-被处理的百分率为_________ 。
(5)装置中碱石灰的作用是__________ 。
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出H2CO3的结构式
(2)下列能用于判断氮、碳两种元素非金属性强弱的是
a.气态氢化物的稳定性强弱b.最高价氧化物对应水化物酸性强弱
c. Al2O3+N2+3C=2AlN+3CO d.比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-。CNO-在酸性条件下继续被NaClO氧化生成N2与CO2。某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率。

将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为
②上述实验是通过测定CO2的量来确定CN-的处理效果。若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是
(5)装置中碱石灰的作用是
您最近一年使用:0次



