2014高三·全国·专题练习
名校
1 . NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:__________________________ 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
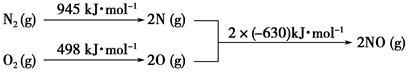
①写出该反应的热化学方程式:_______________________________ 。
②随温度升高,该反应化学平衡常数的变化趋势是____ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:______________________________
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是___________________________________________ ,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
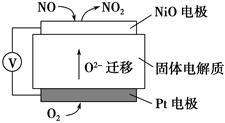
①Pt电极上发生的是________ 反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:______________________________________ 。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①写出该反应的热化学方程式:
②随温度升高,该反应化学平衡常数的变化趋势是
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
2020-09-13更新
|
1850次组卷
|
6卷引用:2014-2015福建省福州市第八中学高二下学期期中化学试卷
2014-2015福建省福州市第八中学高二下学期期中化学试卷(已下线)2014届高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(已下线)2014届高考化学二轮复习四川配套训练 第9讲非金属元素化合物练习卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷步步为赢 高二化学寒假作业:综合检测(一)北京市昌平区昌平区第一中学2020届高三下学期第三次模拟考试化学试题
2 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___ 。
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___ mol•L-1•min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
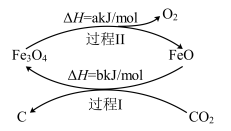
①在转化过程中起催化作用的物质是___ ;
②写出总反应的化学方程式___ 。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H___ 0。(填“>”、“<”或“=”);
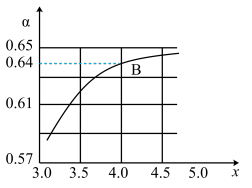
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___ ;B点处,NH3的平衡转化率为___ 。
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)
 C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g)
 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的
 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
您最近一年使用:0次
2019-12-06更新
|
709次组卷
|
6卷引用:吉林省吉林市普通高中2020届高三上学期第一次调研测试化学试题
解题方法
3 . 苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: (g)
(g)
 (g)+H2(g) △H=+17.6kJ/mol
(g)+H2(g) △H=+17.6kJ/mol
(1)在刚性容器中要提高乙苯平衡转化率,可采取的措施有______
(2)实际生产中往刚性容器中同时通入乙苯和水蒸气,测得容器总压和乙苯转化率随时间变化结果如图所示。

①平衡时,p(H2O)=_____ kPa,平衡常数Kp=_____ kPa(Kp为以分压表示的平衡常数)
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的
______ 。
(3)O2气氛下乙苯催化脱氢同可时存在以下两种途径:

①a=________ 。
②途径I的反应历程如图所示,下列说法正确的是_____
a.CO2为氧化剂 b.状态1到状态2形成了O-H键
c.中间产物只有( ) d.该催化剂可提高乙苯的平衡转化率
) d.该催化剂可提高乙苯的平衡转化率
③pCO2与乙苯平衡转化率关系如图分析,pCO2为15kPa时乙苯平衡转化率最高的原因______ 。


 (g)
(g)
 (g)+H2(g) △H=+17.6kJ/mol
(g)+H2(g) △H=+17.6kJ/mol(1)在刚性容器中要提高乙苯平衡转化率,可采取的措施有
(2)实际生产中往刚性容器中同时通入乙苯和水蒸气,测得容器总压和乙苯转化率随时间变化结果如图所示。

①平衡时,p(H2O)=
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的

(3)O2气氛下乙苯催化脱氢同可时存在以下两种途径:

①a=
②途径I的反应历程如图所示,下列说法正确的是
a.CO2为氧化剂 b.状态1到状态2形成了O-H键
c.中间产物只有(
 ) d.该催化剂可提高乙苯的平衡转化率
) d.该催化剂可提高乙苯的平衡转化率③pCO2与乙苯平衡转化率关系如图分析,pCO2为15kPa时乙苯平衡转化率最高的原因


您最近一年使用:0次
名校
4 . 回答下列问题:
(1)在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl— [CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是___________________________ 。
(2)二甲醚[CH3OCH3]燃料电池的工作原理如图所示.

该电池负极的电极反应式为:_______________________ 。
(3)已知在一定温度下:
C(s)+CO2(g) 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是:_____________ 。
(4)把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为__________ 。
(1)在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl—
 [CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是(2)二甲醚[CH3OCH3]燃料电池的工作原理如图所示.

该电池负极的电极反应式为:
(3)已知在一定温度下:
C(s)+CO2(g)
 2CO(g)平衡常数K;
2CO(g)平衡常数K;C(s) + H2O(g)
 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;CO(g)+H2O(g)
 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,则K、K1、K2之间的关系是:
(4)把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为
您最近一年使用:0次
名校
5 . 按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的________________ 。
(2)氯化铝溶液具有净水的作用,原因是(用离子方程式表示):_______________ 。
(3)已知CO (g) + H2O (g) CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正
CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________ v逆(填“>”“<”或“=”)。
(4)将25℃下pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a:b=_____________________ 。
(5)写出0.1mol/LNaOH溶液1L与标准状况下1.12LCO2完全反应后所得的溶液中各种离子浓度由大到小的顺序为____________________________ 。
(6)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为________________ 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗标准状况下的CO 的体积为224 mL,则溶液的pH = ___________ 。(不考虑溶液体积的变化)

(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的
(2)氯化铝溶液具有净水的作用,原因是(用离子方程式表示):
(3)已知CO (g) + H2O (g)
 CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正
CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正(4)将25℃下pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a:b=
(5)写出0.1mol/LNaOH溶液1L与标准状况下1.12LCO2完全反应后所得的溶液中各种离子浓度由大到小的顺序为
(6)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为

您最近一年使用:0次
2019-01-02更新
|
293次组卷
|
3卷引用:福建省漳平市第一中学2018-2019学年高二上学期第二次月考化学试题
福建省漳平市第一中学2018-2019学年高二上学期第二次月考化学试题(已下线)期末综合测试卷02-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)江西省南昌市知行中学2021-2022学年高二上学期12月月考化学试题
名校
6 . 纳米级Cu2O由于具有优良的催化性能而受到科学家的不断关注,下列为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是_________________________ 。
(2)方法Ⅱ利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________ ;电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解,通过离子交换膜的阴离子的物质的量为________ mol。(离子交换膜只允许OH-通过)
(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制的Cu(OH)2来制备纳米级Cu2O,同时放出N2。生成1molN2时,生成Cu2O的物质的量为________________ 。
(4)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。写出肼-空气燃料电池放电时负极的电极反应式:___________________________ 。
| 方法Ⅰ | 用碳粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,原理为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是
(2)方法Ⅱ利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为

(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制的Cu(OH)2来制备纳米级Cu2O,同时放出N2。生成1molN2时,生成Cu2O的物质的量为
(4)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。写出肼-空气燃料电池放电时负极的电极反应式:
您最近一年使用:0次
名校
解题方法
7 . 电解饱和食盐水是氯碱工业基础。
(1)写出电解饱和氯化钠溶液时的总的离子反应方程式:________________________________________ 。
(2)当阴极产生1molH2时,通过阳离子交换膜的Na+有_________ mol;
(3)产生的氯气可用于制TiCl4,但TiO2与Cl2难以直接反应,加碳生成CO、CO2可使反应得以进行。回答:
已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol﹣1
2C(s) + O2(g)=2CO(g)△H2=﹣220.9kJ•mol﹣1
①TiO2与Cl2难以直接反应的原因是__________________________________________
②加碳生成CO、CO2后得以进行原因是________________________________________________________
(4)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中Y是________ (填化学式);
②写出燃料电池B中负极上发生的电极反应:______________________________________________
③比较图示中氢氧化钠溶液质量分数的大小:a%_______ b%(填>、=或<)
(1)写出电解饱和氯化钠溶液时的总的离子反应方程式:
(2)当阴极产生1molH2时,通过阳离子交换膜的Na+有
(3)产生的氯气可用于制TiCl4,但TiO2与Cl2难以直接反应,加碳生成CO、CO2可使反应得以进行。回答:
已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol﹣1
2C(s) + O2(g)=2CO(g)△H2=﹣220.9kJ•mol﹣1
①TiO2与Cl2难以直接反应的原因是
②加碳生成CO、CO2后得以进行原因是
(4)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中Y是
②写出燃料电池B中负极上发生的电极反应:
③比较图示中氢氧化钠溶液质量分数的大小:a%
您最近一年使用:0次
名校
8 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_________________ 。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是______________________ 。
“滤液”中的溶质主要是__________________ 。
(3)KIO3也可采用“电解法”制备,装置如图所示。

①写出电解时阴极的电极反应式________________________________ 。
②电解过程中通过阳离子交换膜的离子主要为_______________ 。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有___________________________________________ (写出一点)。
(1)KIO3的化学名称是
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是
“滤液”中的溶质主要是
(3)KIO3也可采用“电解法”制备,装置如图所示。

①写出电解时阴极的电极反应式
②电解过程中通过阳离子交换膜的离子主要为
③与“电解法”相比,“KClO3氧化法”的主要不足之处有
您最近一年使用:0次
解题方法
9 . 氮氧化物是造成酸雨、臭氧空洞、光化学烟雾等环境问题的主要原因之一。如何消除大气污染物中氮氧化物已成为人们关注的主要问题之一。
I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O2 4N2+6H2O
4N2+6H2O
(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(1) △H =-1891.5kJ•mol-1
4N2(g)+6H2O(1) △H =-1891.5kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H =+180.5kJ•mol-1
2NO(g) △H =+180.5kJ•mol-1
③H2O(1)=H2O(g) △H =+44.0kJ•mol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为_________________________________ 。
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。

①工业上选择催化剂乙的原因是_________________ 。
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是_______________________ 。
Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJ•mol-1
(3)在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
由表中数据,计算0-4min内v(NO2)=____________ ,该温度下的平衡常数K=________________ 。
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率α(NO2)如下图,则下列叙述正确的是_____________

A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
(5)清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)的NOx电化学还原技术,为大气污染物治理开拓了新颖的思路。SOEC反应器的工作原理如图所示。电源的a 是________ 极。写出阴极的电极反应式:__________________________________ 。

I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O2
 4N2+6H2O
4N2+6H2O(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(1) △H =-1891.5kJ•mol-1
4N2(g)+6H2O(1) △H =-1891.5kJ•mol-1②N2(g)+O2(g)
 2NO(g) △H =+180.5kJ•mol-1
2NO(g) △H =+180.5kJ•mol-1③H2O(1)=H2O(g) △H =+44.0kJ•mol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。

①工业上选择催化剂乙的原因是
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是
Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJ•mol-1
(3)在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据,计算0-4min内v(NO2)=
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率α(NO2)如下图,则下列叙述正确的是

A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
(5)清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)的NOx电化学还原技术,为大气污染物治理开拓了新颖的思路。SOEC反应器的工作原理如图所示。电源的a 是

您最近一年使用:0次
10 . 目前世界上新建的金矿中约有80%都采用氧化法提金。某工厂利用锌冶炼渣回收金、银等贵金属的流程如下图所示:

已知:HCN有剧毒,其Ka(HCN)=5×10-10,
Au++2CN-=[Au(CN)2]-平衡常数KB=1×1038
(1)磨矿细度对浸出率的影响如图所示,依据浸出率应选择磨矿细度_____ 为宜。

(2)生产中用生石灰调节矿泥pH>11.5,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是________________ (用离子方程式表示)。
(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,将Au转换为Na[Au(CN)2]。
①其化学方程式为________________ 。
② “氰化”环节中,金的溶解速率在80℃时达到最大值,但生产中控制反应液的温度在10-20℃,原因是:___________________________ (答一点即可)。
③已知2H++[Au(CN)2]- Au++2HCN,该反应的K=
Au++2HCN,该反应的K=____________ 。
(4)用锌还原NaAu(CN)2生成金,消耗的锌与生成的金的物质的量之比为____________ 。
(5)氰化物有剧毒,经合理处理就可以基本消除对环境的负面影响。H2O2可消除水中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑。
①生成物A的化学式为______________ 。
②某废水用H2O2处理40min后,测得剩余总氰为0.16mg/L,除氰率达80%,计算0-40min时间段反应速率v(CN-)=____ mg/(L·min)(结果保留两位有效数字)。

已知:HCN有剧毒,其Ka(HCN)=5×10-10,
Au++2CN-=[Au(CN)2]-平衡常数KB=1×1038
(1)磨矿细度对浸出率的影响如图所示,依据浸出率应选择磨矿细度

(2)生产中用生石灰调节矿泥pH>11.5,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是
(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,将Au转换为Na[Au(CN)2]。
①其化学方程式为
② “氰化”环节中,金的溶解速率在80℃时达到最大值,但生产中控制反应液的温度在10-20℃,原因是:
③已知2H++[Au(CN)2]-
 Au++2HCN,该反应的K=
Au++2HCN,该反应的K=(4)用锌还原NaAu(CN)2生成金,消耗的锌与生成的金的物质的量之比为
(5)氰化物有剧毒,经合理处理就可以基本消除对环境的负面影响。H2O2可消除水中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑。
①生成物A的化学式为
②某废水用H2O2处理40min后,测得剩余总氰为0.16mg/L,除氰率达80%,计算0-40min时间段反应速率v(CN-)=
您最近一年使用:0次



