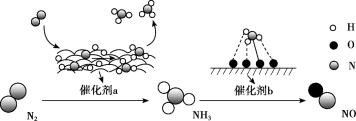
| A.催化剂a表面只发生极性共价键的断裂和形成 |
| B.N2与H2反应生成NH3的原子利用率为100% |
| C.在催化剂b表面形成氮氧键时,不涉及电子转移 |
| D.催化剂a、b能提高反应的平衡转化率 |
| A.用石墨电极电解熔融 Al2O3时,阳极须定期更换 |
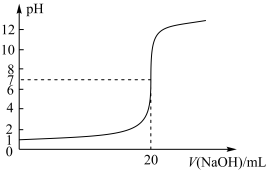
| B.如上图所示为向10 mL一定浓度的HCl溶液中滴加NaOH溶液时,所得室温下溶液pH随NaOH溶液体积的变化,由图可知c(NaOH)=0.1 mol·L−1 |
| C.由方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol−1可知甲烷的燃烧热为890.3 kJ·mol−1 |
D.C(s)+H2O(g)  CO(g)+H2(g)在一定条件下能自发进行的原因是ΔH>0 CO(g)+H2(g)在一定条件下能自发进行的原因是ΔH>0 |
(1) 甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ.CH3OH(g)+H2O(g)⇌3H2(g)+CO2(g);ΔH1
反应Ⅱ.H2(g)+CO2(g)⇌H2O(g)+CO(g);ΔH2=a kJ·mol-1
反应Ⅲ.CH3OH(g)⇌2H2(g)+CO(g);ΔH3=b kJ·mol-1
反应Ⅳ.2CH3OH(g)⇌2H2O(g)+C2H4(g);ΔH4=c kJ·mol-1
①ΔH1=
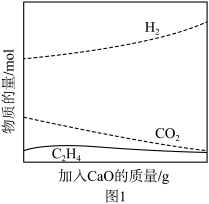
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,加入CaO提高氢气产率的原因是
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中
 对反应的选择性影响如图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制 =
= =0.25时,CH3OH和O2发生的主要反应方程式为
=0.25时,CH3OH和O2发生的主要反应方程式为
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1 000 kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90 min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是

(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。

①电源的正极为
②阴极的电极反应式为
(1)H2O2的电子式为
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。
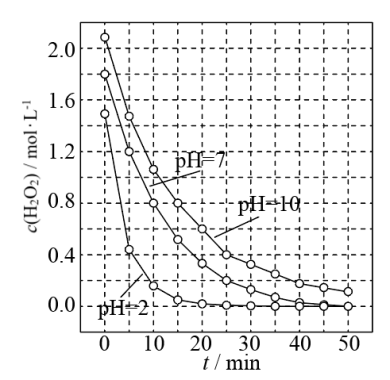
①pH=7时,0~10minH2O2分解反应的平均速率υ=
②以下对图象的分析正确的是
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为
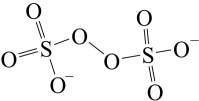 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
(1)传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g)
 C2H4(g)+H2(g) ΔH
C2H4(g)+H2(g) ΔH①已知:298K时,相关物质的相对能量如图:则ΔH=
②850℃,恒压条件下,常需要通入大量水蒸气,目的是
(2)乙烷氧化裂解制乙烯[主反应为C2H6(g)+1/2O2(g)
 C2H4(g)+H2O (g)]
C2H4(g)+H2O (g)]①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g)
 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是②探究该反应的适宜条件,得到下图数据:
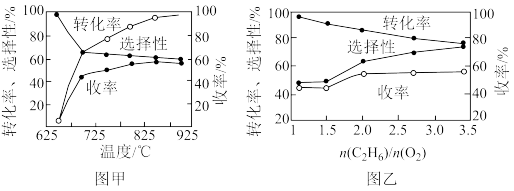
已知:C2H4的选择性:指转化的C2H6中生成C2H4的百分比;乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中
 的变化情况。
的变化情况。用该方法制备乙烯应该选择的适宜条件为:温度
 =
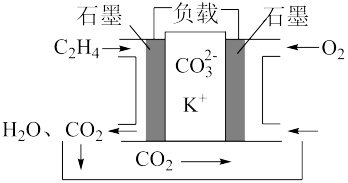
=(3)某乙烯熔融燃料电池工作原理如下图所示:则负极的电极反应式为
(1)已知:
反应Ⅰ:Fe2O3(s)+3H2(g)═2Fe(s)+3H2O(g)ΔH1═+89.6kJ·mol−1
反应Ⅱ:4Fe2O3(s)+Fe(s)═3Fe3O4(s)ΔH2═+2833.4kJ·mol−1
反应Ⅲ:Fe3O4(s)+4H2(g)═4H2O(g)+3Fe(s)ΔH3
反应Ⅰ的平衡常数表达式K═
(2)在水膜酸性不强的情况下,钢铁在潮湿的空气中腐蚀生锈主要属于
(3)电化学除锈法具有侵蚀能力强,侵蚀速度快等优点。电化学除锈分为阳极除锈和阴极除锈。阳极除锈是利用阳极的电化学溶解和氧气泡析出时对铁锈的机械剥离作用进行除锈;阴极除锈是利用氢气的还原作用和氢气泡析出的机械剥离作用而除锈。如图为一种电化学除锈示意图。
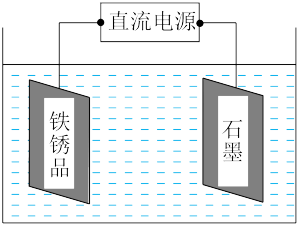
①若采用阳极除锈,以H2SO4(aq)为电解质溶液,则阳极的电极反应式为
②若采用阴极除锈,以Na2CO3(aq)为电解质溶液,则阴极的电极反应式为
(4)钢铁工件除锈后,还可采用电镀进行防护,若要在工件上镀上金属铬,应把钢铁工件放在电镀池的
 、HSO
、HSO )溶胶是”PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:
)溶胶是”PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:
下列说法正确的是( )
| A.H2O没有参与该过程 | B.NO2是生成硫酸盐的还原剂 |
| C.硫酸盐气溶胶呈酸性 | D.该过程中没有共价键生成 |
 和NH3·H2O的形式存在,该废水处理流程如图所示:
和NH3·H2O的形式存在,该废水处理流程如图所示:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用:
(2)过程Ⅱ:在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。其中第一步反应的能量变化示意如图:
。其中第一步反应的能量变化示意如图:
已知第二步反应:2NO
 (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq),ΔH=-146 kJ∙mol−1
(aq),ΔH=-146 kJ∙mol−1则1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(3)过程Ⅲ:利用生成的HNO3进行一系列的工业生产。其中一种就是以HNO3为原料来制取新型硝化剂N2O5。现以H2、O2、熔融的Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。

①石墨Ⅰ电极上发生反应的电极反应式:
②在电解池中生成N2O5的电极反应式:
③整个电解过程中,若有4.48L(标况下)O2参加反应,则能够得到N2O5
Ⅰ.干法脱硫
(1)已知①H2S(g)+
 O2(g)=SO2(g)+H2O(g) ΔH1=-a kJ∙mol-1,
O2(g)=SO2(g)+H2O(g) ΔH1=-a kJ∙mol-1,②S(s)+O2(g)=SO2(g) ΔH2=-b kJ∙mol-1
则常温下空气直接氧化脱除H2S的反应:2H2S(g)+O2(g)=2S(s)+2H2O(l) ∆H=
(2)常用脱硫剂的脱硫效果及反应条件如下表,最佳脱硫剂为
| 脱硫剂 | 出口硫(mg·m-3) | 脱硫温度(℃) | 操作压力(MPa) | 再生条件 |
| 一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸气再生 |
| 活性炭 | <1.33 | 常温 | 0~3.0 | 蒸气再生 |
| 氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
| 锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生热分解反应H2S(g)
 H2(g)+
H2(g)+ S2(g)控制不同的温度和压强进行实验,结果如图(a)。
S2(g)控制不同的温度和压强进行实验,结果如图(a)。
(3)图(a)中压强关系p1、p2、p3由大到小的顺序为
(4)若压强为p2、温度为975℃时,H2S(g)
 H2(g)+
H2(g)+ S2(g)的平衡常数K=0.04,则起始浓度c=
S2(g)的平衡常数K=0.04,则起始浓度c=Ⅲ.间接电解法脱硫
间接电解法是通过FeCl3溶液吸收并氧化H2S气体,将反应后溶液通过电解再生,实现循环使用,该法处理过程如图(b)。
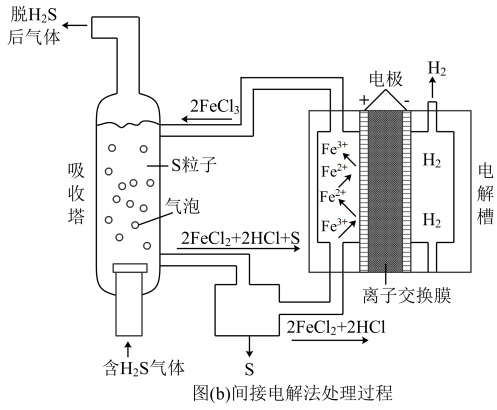
(5)电解反应器中阳极的电极反应式为
(6)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图(c)所示,随着气液比减小,H2S的吸收速率逐渐降低,而吸收率呈上升趋势的原因为

10 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家GethardErtl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如图:

下列说法正确的是
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)关于合成氨工艺的理解,下列错误的是
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10MPa一30MPa的高压,是因常压下N2和H2的转化率不高
D.将合成后混合气体中的氨液化,剩余气体可以循环利用
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1∶3时,平衡混合物中氨的体积分数[φ(NH3)]。

①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)
②在250℃、1.0×104kPa下,N2的转化率为
(4)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因
(5)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol•min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是
②温度为T,在一体积固定的密闭容器中加入2molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=



