1 . 火法炼铜是目前世界上最主要的冶炼铜的方法,其产量可占到铜总产量的85%以上,火法炼铜相关的方程式有
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ΔH1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) ΔH2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是__ 。
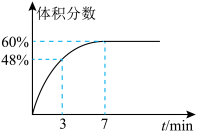
(2)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=__ mol/(L·min),该温度下反应的平衡常数KP=__ (KP为以分压表示的平衡常数)。若保持温度不变向平衡体系中再通入1mol氧气,达到新平衡后氧气的体积分数__ (填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ΔH1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) ΔH2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是
(2)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=

您最近一年使用:0次
解题方法
2 . 磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

图1
①亚磷酸属于______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)=______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:
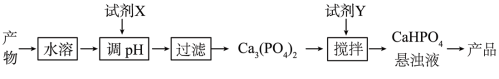
图2
①试剂X为______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液
(3)工业制备PH3的流程如图1所示:

图1
①亚磷酸属于
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)=
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:
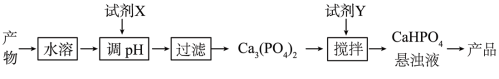
图2
①试剂X为
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH
您最近一年使用:0次
2019-12-08更新
|
289次组卷
|
3卷引用:福建省2020届高三化学大题练——化工流程为载体的综合实验
解题方法
3 . 工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
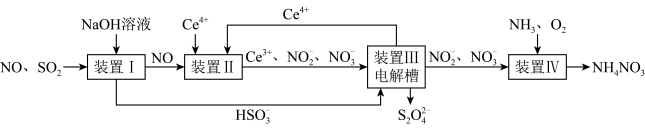
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式______ .
(2)含硫各微粒(H2SO3、 和
和 )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.

①下列说法正确的是______ (填标号).
A.pH=7时,溶液中c(Na+)=3c( )
)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c( )+c(H2SO3)
)+c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为______ .
③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定,酸性高锰酸钾溶液应装在______ (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是______
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中A为电源的______ (填“正”或“负”)极.右侧反应室中发生的主要电极反应式为______ .
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为______ L.

请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式
(2)含硫各微粒(H2SO3、
 和
和 )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
①下列说法正确的是
A.pH=7时,溶液中c(Na+)=3c(
 )
)B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(
 )+c(H2SO3)
)+c(H2SO3)②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为
③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定,酸性高锰酸钾溶液应装在
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中A为电源的
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为
您最近一年使用:0次
2019-12-08更新
|
430次组卷
|
3卷引用:福建省2020届高三化学大题练——化工流程为载体的综合实验
4 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___ 。
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___ mol•L-1•min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
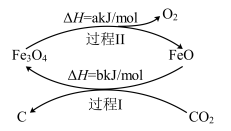
①在转化过程中起催化作用的物质是___ ;
②写出总反应的化学方程式___ 。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H___ 0。(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___ ;B点处,NH3的平衡转化率为___ 。
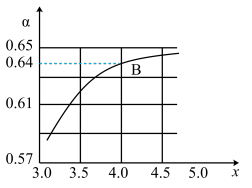
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)
 C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g)
 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的
 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
您最近一年使用:0次
2019-12-06更新
|
709次组卷
|
6卷引用:吉林省吉林市普通高中2020届高三上学期第一次调研测试化学试题
名校
解题方法
5 . 回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g) 2NO2(g),正反应的活化能为c kJ•molˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJ•molˉ1。该反应历程为:
第一步:2NO(g ) N2O2(g) △H1 =-a kJ•molˉ1(快反应)
N2O2(g) △H1 =-a kJ•molˉ1(快反应)
第二步:N2O2(g ) + O2(g) 2NO2(g) △H2 =-b kJ•molˉ1(慢反应)
2NO2(g) △H2 =-b kJ•molˉ1(慢反应)
①下列对上述反应过程表述正确的是__________ (填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________ 。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g) 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
①与实验a相比,实验b改变的实验条件可能是______________________ 。
②实验b中的平衡转化率a(SO2)=_________ 。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:

①曲线c对应NH3与NO 的物质的量之比是_______________ 。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3•s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________ (已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
(1)已知:2NO(g ) + O2(g)
 2NO2(g),正反应的活化能为c kJ•molˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJ•molˉ1。该反应历程为:第一步:2NO(g )
 N2O2(g) △H1 =-a kJ•molˉ1(快反应)
N2O2(g) △H1 =-a kJ•molˉ1(快反应)第二步:N2O2(g ) + O2(g)
 2NO2(g) △H2 =-b kJ•molˉ1(慢反应)
2NO2(g) △H2 =-b kJ•molˉ1(慢反应)①下列对上述反应过程表述正确的是
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)
 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示: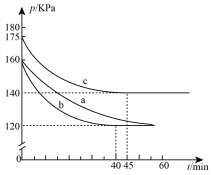
①与实验a相比,实验b改变的实验条件可能是
②实验b中的平衡转化率a(SO2)=
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO
 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
①曲线c对应NH3与NO 的物质的量之比是
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液
 Na2SO3溶液
Na2SO3溶液①用化学方程式表示NaOH 再生的原理
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
2019-12-02更新
|
338次组卷
|
4卷引用:福建省泉州第十六中学2020届高三11月理科综合能力测试(二)化学试题
福建省泉州第十六中学2020届高三11月理科综合能力测试(二)化学试题【市级联考】湖北省武汉市2019届高三下学期五月训练题理科综合化学试题【懂做原理题】2020届高三化学选修4二轮专题练——弱电解质的电离平衡及其影响因素综合考查【精编23题】(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升
名校
解题方法
6 . 碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2 平衡常数为K2
FeO(s)+H2(g) ΔH2 平衡常数为K2
不同温度下,K1、K2的值如下表:

现有反应Ⅲ:H2(g)+CO2(g) CO(g)+H2O(g),结合上表数据,反应Ⅲ是
CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:
2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ∆H<0。
C2H5OH(g)+3H2O(g) ∆H<0。
设m为起始时的投料比,即m= n(H2)/ n(CO2)。

①图1中投料比相同,温度从高到低的顺序为______________________ 。
②图2中m1、m2、m3从大到小的顺序为________________________ 。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为______________ ,T4温度时,该反应平衡常数KP的计算式为(不必化简)_______________________ 。
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH___________ 7(填“>”、“=”或“<”)。烟气需冷却至15.5℃~26.5℃的可能原因是____________ 。

(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________ 。
(1)反应Ⅰ:Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1反应Ⅱ:Fe(s)+H2O(g)
 FeO(s)+H2(g) ΔH2 平衡常数为K2
FeO(s)+H2(g) ΔH2 平衡常数为K2不同温度下,K1、K2的值如下表:

现有反应Ⅲ:H2(g)+CO2(g)
 CO(g)+H2O(g),结合上表数据,反应Ⅲ是
CO(g)+H2O(g),结合上表数据,反应Ⅲ是(2)已知CO2催化加氢合成乙醇的反应原理为:
2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) ∆H<0。
C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。

①图1中投料比相同,温度从高到低的顺序为
②图2中m1、m2、m3从大到小的顺序为
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH

(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为
您最近一年使用:0次
2019-11-22更新
|
604次组卷
|
6卷引用:湖北省荆州中学、宜昌一中、龙泉中学三校2020届高三期中联考理综化学试题
湖北省荆州中学、宜昌一中、龙泉中学三校2020届高三期中联考理综化学试题2020届高三《新题速递·化学》12月第01期(考点07-11)(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(八)(已下线)考点10 化学平衡常数及其图象分析-2020年高考化学命题预测与模拟试题分类精编福建省福州第一中学2021届高三下学期开学考试化学试题2020届高三化学二轮冲刺新题专练——化学反应原理综合题
名校
7 . 下列说法不正确的是
| A.铅蓄电池在放电过程中,正极得到电子,电极质量增加 |
B.0.1mol/L CH3COOH溶液加水稀释后,溶液中 减小 减小 |
| C.SiO2(s)+2C(s)=Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0 |
| D.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率 |
您最近一年使用:0次
名校
解题方法
8 . 中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下: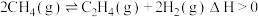
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的
______  用含a、b、c、d的代数式表示
用含a、b、c、d的代数式表示 。
。

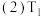 温度时,向1L的恒容反应器中充入2
温度时,向1L的恒容反应器中充入2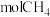 ,仅发生上述反应,反应过程中
,仅发生上述反应,反应过程中 min
min 的物质的量随时间变化如图1,测得
的物质的量随时间变化如图1,测得 min时
min时 的浓度为
的浓度为
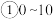 min内
min内 表示的反应速率为
表示的反应速率为______ 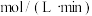

 若图1中曲线a、曲线b分别表示在温度
若图1中曲线a、曲线b分别表示在温度 时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n
时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n 的变化曲线,其中表示催化剂表面积较大的曲线是
的变化曲线,其中表示催化剂表面积较大的曲线是______ (填“a“或“b”)。
 min时,若改变外界反应条件,导致
min时,若改变外界反应条件,导致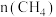 发生图中所示变化,则改变的条件可能是
发生图中所示变化,则改变的条件可能是_______  任答一条即可
任答一条即可 。
。
 实验测得:
实验测得: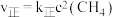 ,
,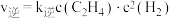 ,其中
,其中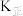 、
、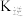 为速率常数仅与温度有关,
为速率常数仅与温度有关, 温度时
温度时 与
与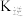 的比值为
的比值为______ (填数值)。若将温度由 升高到
升高到 ,则反应速率增大的倍数
,则反应速率增大的倍数
______ V逆 (选填“ ”、“
”、“ ”或“<”)。
”或“<”)。
 科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了
科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 与
与 的固体,可在高温下传导
的固体,可在高温下传导
 极为
极为______ 极(选填“阳”或“阴”)。
 该电池工作时负极反应方程式为
该电池工作时负极反应方程式为________ 。
 用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为11.2L,则透过阳离子交换膜的离子的物质的量为
用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为11.2L,则透过阳离子交换膜的离子的物质的量为_________ mol
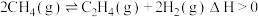
| 化学键 |  |  |  |  |
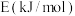 | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的

 用含a、b、c、d的代数式表示
用含a、b、c、d的代数式表示 。
。
 温度时,向1L的恒容反应器中充入2
温度时,向1L的恒容反应器中充入2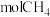 ,仅发生上述反应,反应过程中
,仅发生上述反应,反应过程中 min
min 的物质的量随时间变化如图1,测得
的物质的量随时间变化如图1,测得 min时
min时 的浓度为
的浓度为
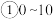 min内
min内 表示的反应速率为
表示的反应速率为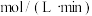

 若图1中曲线a、曲线b分别表示在温度
若图1中曲线a、曲线b分别表示在温度 时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n
时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n 的变化曲线,其中表示催化剂表面积较大的曲线是
的变化曲线,其中表示催化剂表面积较大的曲线是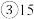 min时,若改变外界反应条件,导致
min时,若改变外界反应条件,导致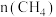 发生图中所示变化,则改变的条件可能是
发生图中所示变化,则改变的条件可能是 任答一条即可
任答一条即可 。
。 实验测得:
实验测得: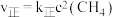 ,
,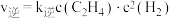 ,其中
,其中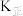 、
、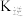 为速率常数仅与温度有关,
为速率常数仅与温度有关, 温度时
温度时 与
与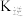 的比值为
的比值为 升高到
升高到 ,则反应速率增大的倍数
,则反应速率增大的倍数
 ”、“
”、“ ”或“<”)。
”或“<”)。 科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了
科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 与
与 的固体,可在高温下传导
的固体,可在高温下传导
 极为
极为 该电池工作时负极反应方程式为
该电池工作时负极反应方程式为 用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为11.2L,则透过阳离子交换膜的离子的物质的量为
用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为11.2L,则透过阳离子交换膜的离子的物质的量为
您最近一年使用:0次
名校
9 . 通过CH4超干重整CO2技术可得到富含CO的化工原料,其过程如下图所示。下列说法错误的是( )
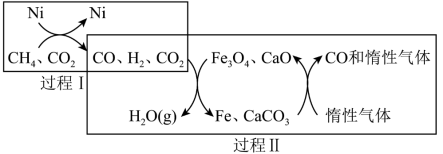
A.过程Ⅰ的化学方程式为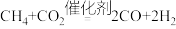 |
B.过程Ⅱ的化学方程式为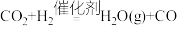 |
| C.该技术实现了含碳物质与含氢物质的分离 |
| D.Ni、Fe、CaCO3均是上述过程中用到的催化剂 |
您最近一年使用:0次
2019-10-13更新
|
2136次组卷
|
6卷引用:河南省大象联考2020届高三高考质量测评化学试题
名校
10 . 生活污水中的氮和磷主要以铵盐和磷酸盐的形式存在,可用电解法从溶液中除去。有Cl-存在时,除氮原理如图1所示,主要依靠有效氯(HClO、ClO-)将NH4+或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度与溶液pH的关系如图2所示。
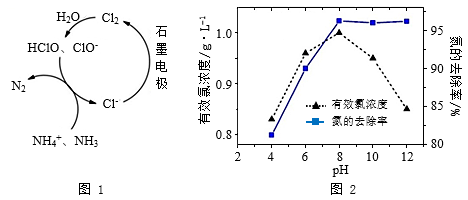
下列说法不正确 的是( )

下列说法
| A.pH=3时,主要发生ClO-氧化NH3的反应 |
| B.pH>8时,有效氯浓度随pH的增大而减小 |
| C.pH>8时,NH4+转变为NH3∙H2O,且有利于NH3逸出 |
| D.pH<8时,氮的去除率随pH的减小而下降的原因是c(HClO)减小 |
您最近一年使用:0次
2019-09-25更新
|
379次组卷
|
5卷引用:福建省厦门双十中学2020届高三上学期期中考试化学试题



