解题方法
1 . (1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2d.CO2
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:__________
(3)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =________ 。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
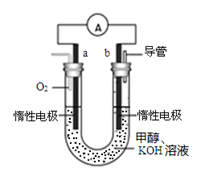
①该电池工作时,负极是_______ 极(填“a”或 “b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为_________________ 。
(5)电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s)+4HCl(aq) 2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
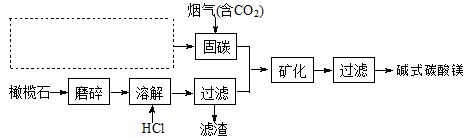
①某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为_____________ 。
②在上图虚框内补充一步工业生产流程______________ 。
③经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是__________ 。
a.NH3 b.HI c.SO2d.CO2
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
(3)工业生产甲醇的常用方法是:CO(g)+2H2(g)
 CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。已知:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =
(4)某实验小组设计了如图所示的甲醇燃料电池装置。

①该电池工作时,负极是
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为
(5)电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s)+4HCl(aq)
 2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
①某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为
②在上图虚框内补充一步工业生产流程
③经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是
您最近一年使用:0次
2016-12-09更新
|
435次组卷
|
2卷引用:福建省2020届高三化学大题练——化工流程为载体的综合实验
2 . 研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
C(s)+H2O(g) CO(g)+H2(g)△H=+131kJ/mol
CO(g)+H2(g)△H=+131kJ/mol
②CO(g)+3H2(g) CH4(g)+H2O(g)△H=akJ/mol
CH4(g)+H2O(g)△H=akJ/mol
查阅资料反应②中相关化学键键能数据如下表:
(1)煤直接甲烷化反应C(s)+2H2(g) CH4(g)的△H为
CH4(g)的△H为_______ kJ/mol,该反应在______ (填“高温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:
2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和C02平衡转化率的影响如图所示:
C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和C02平衡转化率的影响如图所示:

(2)图中低温时,随着温度升高催化剂的催化效率提高,但C02的平衡转化率却反而降低,其原因是__________ 。
(3)250℃时,该反应的平衡常数K值为__________ 。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入lmolCO2和3molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
(4)反应前1小时内的平均反应速率V(H2)为_________ mol/(L·h),该温度下CO2的平衡转化率为_________ 。
IV.电解逆转化制乙醇
(5)科研人员通过反复实验发现:CO2可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在_________ 极(“阴”或“阳”),该电极的反应式为_________ 。
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
C(s)+H2O(g)
 CO(g)+H2(g)△H=+131kJ/mol
CO(g)+H2(g)△H=+131kJ/mol②CO(g)+3H2(g)
 CH4(g)+H2O(g)△H=akJ/mol
CH4(g)+H2O(g)△H=akJ/mol查阅资料反应②中相关化学键键能数据如下表:
| 化学键 |  | H-H | H—C | H-O |
| E/(kJ/mol) | 1072 | 436 | 414 | 465 |
 CH4(g)的△H为
CH4(g)的△H为Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:
2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和C02平衡转化率的影响如图所示:
C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和C02平衡转化率的影响如图所示:
(2)图中低温时,随着温度升高催化剂的催化效率提高,但C02的平衡转化率却反而降低,其原因是
(3)250℃时,该反应的平衡常数K值为
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入lmolCO2和3molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
IV.电解逆转化制乙醇
(5)科研人员通过反复实验发现:CO2可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在
您最近一年使用:0次
名校
解题方法
3 . 作为绿色氧化剂和消毒剂,H2O2在工业生产及日常生活中应用广泛。已知:2H2O2(l)=2H2O(l)+O2(g) △H = -196kJ·mol-1K = 8.29×1040,回答下列问题:
(1)H2O2的电子式为______ ,H2O2能用作消毒剂是因为分子结构中存在______ 键(选填“H-O”或“-O-O-”)。
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的______ (选填编号)。
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。
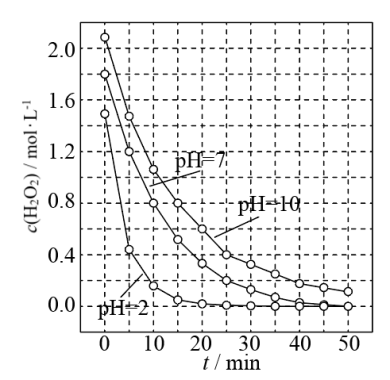
①pH=7时,0~10minH2O2分解反应的平均速率υ=______ mol·L-1·min-1。
②以下对图象的分析正确的是______ (选填序号)。
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因______ 。
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为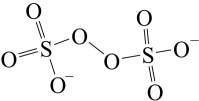 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因_____ 。
(1)H2O2的电子式为
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。

①pH=7时,0~10minH2O2分解反应的平均速率υ=
②以下对图象的分析正确的是
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为
 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
您最近一年使用:0次
2020-12-14更新
|
449次组卷
|
2卷引用:湖北省十一校2021届高三上学期第一次联考化学试题
解题方法
4 . 废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。为研究不同pH下用NaClO氧化废水中的氨氮(用硝酸铵模拟),使其转化为无污染的气体,试剂用量如下表。已知:HClO的氧化性比ClO—的氧化性更强。下列说法错误的是
| pH | 0.100mol/L NH4NO3(mL) | 0.100mol/L NaClO(mL) | 0.200mol/L H2SO4(mL) | 蒸馏水 (mL) | 氨氮去除 率(%) |
| 1.0 | 10.00 | 10.00 | 10.00 | 10.00 | 89 |
| 2.0 | 10.00 | 10.00 | V1 | V2 | 75 |
| 6.0 | …… | …… | …… | …… | 85 |
| A.V1=2.00 |
| B.pH=1时发生反应:3ClO—+2NH4+=3Cl—+N2↑+3H2O+2H+ |
| C.pH从1升高到2,氨氮去除率降低的原因是更多的HClO转化为ClO— |
| D.pH控制在6时再进行处理更容易达到排放标准 |
您最近一年使用:0次
2020-01-29更新
|
172次组卷
|
2卷引用:福建省泉州市2020届普通高中毕业班单科质量检查化学试题
5 . 25℃时,将SO2通入蒸馏水中模拟酸雨形成过程,实验数据如图。已知Ka1(H2SO3)=10-2,Ka2(H2SO3)=10-7。下列说法不正确的是


| A.300s未通O2时溶液中c(H2SO3)=10 -5.46mol·L-1 |
| B.400s时溶液中c(HSO3-)+c(SO32-)+c(SO42-)+c(H2SO3)≈10-3.73mol·L-1 |
| C.600s时,溶液中c(H+)约为c(SO42-)2倍 |
| D.由图推知,H2O2氧化性大于O2 |
您最近一年使用:0次
名校
解题方法
6 . 砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________ 。
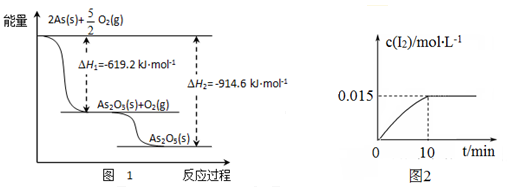
(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______ (填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d. 保持不再变化
保持不再变化
②0~10 min内,I−的反应速率v(I−)=_______ 。
③在该条件下,上述反应的平衡常数K=______ 。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______ 0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______ 。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______ (填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________ 。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式

(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+
 AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。①下列情况表明上述可逆反应达到平衡状态的是
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.
 保持不再变化
保持不再变化②0~10 min内,I−的反应速率v(I−)=
③在该条件下,上述反应的平衡常数K=
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为
您最近一年使用:0次
2017-05-29更新
|
649次组卷
|
5卷引用:福建省厦门外国语学校2017届高三适应性考试理综化学试题
名校
解题方法
7 . 已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,pH相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________ (填序号)
(2)25°C时,pH=4的NH4Cl溶液中各离子浓度的大小关系为____________________ 。
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO‒)________ c(HCO3‒)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________ (填代号)
a.向NaClO溶液中加适量的水b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水d.向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为______________________ 。
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________ (填“酸性”“碱性”“中性”)
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(2)25°C时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO‒)
a.向NaClO溶液中加适量的水b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水d.向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性
您最近一年使用:0次
2018-02-25更新
|
305次组卷
|
6卷引用:【校级联考】福建省福州市八县(市)协作校2018-2019学年高二上学期期末联考化学试题
名校
解题方法
8 . 锌焙砂是锌精矿经焙烧后所得的产物,以锌焙砂为原料制取金属锌的流程如图所示。

已知:①当溶液中Zn2+浓度较大时,Zn2+优先于H+放电。
②碱性条件下Mn(Ⅱ)可以被氧气氧化生成Mn(Ⅵ)。
请回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________ 。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________ 。
②25 ℃时,pH=3的滤液(滤去氢氧化铁沉淀)中,c(Fe3+)=________ mol·L-1(已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38)。
(3)电解硫酸锌溶液时阳极上有气体析出,写出阳极的电极反应式_____________________________ ;
电解时不断补充电解液的目的是_________________________ 。
(4)电解时,阳极附近发生化学反应生成HMnO4,使得溶液变为紫红色,生成的HMnO4,又将Mn2+氧化生成MnO2,一部分二氧化锰沉于槽底形成阳极泥,另一部分附于阳极表面形成保护膜。写出HMnO4将Mn2+氧化生成MnO2的化学方程式__________________ 。

已知:①当溶液中Zn2+浓度较大时,Zn2+优先于H+放电。
②碱性条件下Mn(Ⅱ)可以被氧气氧化生成Mn(Ⅵ)。
请回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:
②25 ℃时,pH=3的滤液(滤去氢氧化铁沉淀)中,c(Fe3+)=
(3)电解硫酸锌溶液时阳极上有气体析出,写出阳极的电极反应式
电解时不断补充电解液的目的是
(4)电解时,阳极附近发生化学反应生成HMnO4,使得溶液变为紫红色,生成的HMnO4,又将Mn2+氧化生成MnO2,一部分二氧化锰沉于槽底形成阳极泥,另一部分附于阳极表面形成保护膜。写出HMnO4将Mn2+氧化生成MnO2的化学方程式
您最近一年使用:0次
9 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡,根据要求回答下列问题:
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象_______________________________________________ 。
(2)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________ 。
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显________ (填“酸性”、“碱性”或“中性”);
②作出上述判断的依据是___________________________________________ (用文字解释)。
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象
(2)AlCl3溶液蒸干并灼烧得到的物质是
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显
②作出上述判断的依据是
您最近一年使用:0次
2017-12-20更新
|
146次组卷
|
2卷引用:福建省福州市2016-2017学年高二上学期期中考试化学试题
名校
解题方法
10 . 铁是一种在生产和生活中应用很广泛的金属元素,请回答下列钢铁腐蚀和防护的相关问题。
(1)已知:
反应Ⅰ:Fe2O3(s)+3H2(g)═2Fe(s)+3H2O(g)ΔH1═+89.6kJ·mol−1
反应Ⅱ:4Fe2O3(s)+Fe(s)═3Fe3O4(s)ΔH2═+2833.4kJ·mol−1
反应Ⅲ:Fe3O4(s)+4H2(g)═4H2O(g)+3Fe(s)ΔH3
反应Ⅰ的平衡常数表达式K═__ ,ΔH3═__ 。
(2)在水膜酸性不强的情况下,钢铁在潮湿的空气中腐蚀生锈主要属于__ 腐蚀。(填“吸氧”或“析氢”)
(3)电化学除锈法具有侵蚀能力强,侵蚀速度快等优点。电化学除锈分为阳极除锈和阴极除锈。阳极除锈是利用阳极的电化学溶解和氧气泡析出时对铁锈的机械剥离作用进行除锈;阴极除锈是利用氢气的还原作用和氢气泡析出的机械剥离作用而除锈。如图为一种电化学除锈示意图。
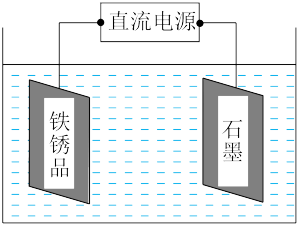
①若采用阳极除锈,以H2SO4(aq)为电解质溶液,则阳极的电极反应式为__ 。
②若采用阴极除锈,以Na2CO3(aq)为电解质溶液,则阴极的电极反应式为___ 。
(4)钢铁工件除锈后,还可采用电镀进行防护,若要在工件上镀上金属铬,应把钢铁工件放在电镀池的___ 极(填“阴”或“阳”)。
(1)已知:
反应Ⅰ:Fe2O3(s)+3H2(g)═2Fe(s)+3H2O(g)ΔH1═+89.6kJ·mol−1
反应Ⅱ:4Fe2O3(s)+Fe(s)═3Fe3O4(s)ΔH2═+2833.4kJ·mol−1
反应Ⅲ:Fe3O4(s)+4H2(g)═4H2O(g)+3Fe(s)ΔH3
反应Ⅰ的平衡常数表达式K═
(2)在水膜酸性不强的情况下,钢铁在潮湿的空气中腐蚀生锈主要属于
(3)电化学除锈法具有侵蚀能力强,侵蚀速度快等优点。电化学除锈分为阳极除锈和阴极除锈。阳极除锈是利用阳极的电化学溶解和氧气泡析出时对铁锈的机械剥离作用进行除锈;阴极除锈是利用氢气的还原作用和氢气泡析出的机械剥离作用而除锈。如图为一种电化学除锈示意图。

①若采用阳极除锈,以H2SO4(aq)为电解质溶液,则阳极的电极反应式为
②若采用阴极除锈,以Na2CO3(aq)为电解质溶液,则阴极的电极反应式为
(4)钢铁工件除锈后,还可采用电镀进行防护,若要在工件上镀上金属铬,应把钢铁工件放在电镀池的
您最近一年使用:0次



