名校
解题方法
1 . 以银精矿(主要成分为Ag2S)为原料采用“预氧化湿法提银”工艺流程如下:
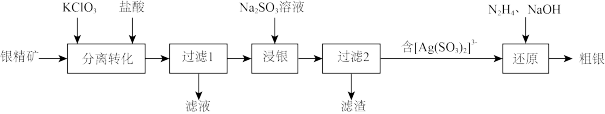
(1)N2H4的电子式为________________________ 。
(2)“分离转化”时,Ag2S转化为AgCl和S的化学方程式为______________ (ClO3-还原为Cl- );为提高Ag2S的转化率可采取的措施是_____________ (列举2条)。已知:Ksp(Ag2S)=1. 6×10-49 ,Ksp(AgCl)=2. 0×10-10 ,若不加KClO3,直接加氯化物,依据反应Ag2S+2Cl- 2AgCl+S2- ,能否实现其较完全转化?并说明理由:
2AgCl+S2- ,能否实现其较完全转化?并说明理由:________________
(3)“浸银”时,发生反应的离子方程式为________________________ 。
(4)“还原”时,2[ Ag(SO3)2]3- +N2H4+2OH -=2Ag↓+4SO32- +N2↑+H2↑+ 2H2O,该反应每生成1 mol Ag转移电子的物质的量为___________ 。

(1)N2H4的电子式为
(2)“分离转化”时,Ag2S转化为AgCl和S的化学方程式为
 2AgCl+S2- ,能否实现其较完全转化?并说明理由:
2AgCl+S2- ,能否实现其较完全转化?并说明理由:(3)“浸银”时,发生反应的离子方程式为
(4)“还原”时,2[ Ag(SO3)2]3- +N2H4+2OH -=2Ag↓+4SO32- +N2↑+H2↑+ 2H2O,该反应每生成1 mol Ag转移电子的物质的量为
您最近一年使用:0次
解题方法
2 . 煤的气化和液化是目前实现煤综合利用的主要途径之一。以粗煤为原料合成甲醇的流程如下:

(1)煤燃烧产生的大气污染物中,能形成酸雨的有___ (填字母)。
a.SO2 b.NOx
(2)过程Ⅱ中的主要反应为:C+H2O=CO+H2,反应类型是___ 。
(3)过程Ⅲ中反应的化学方程式是___ 。
(4)将煤加工处理的意义是___ 。

(1)煤燃烧产生的大气污染物中,能形成酸雨的有
a.SO2 b.NOx
(2)过程Ⅱ中的主要反应为:C+H2O=CO+H2,反应类型是
(3)过程Ⅲ中反应的化学方程式是
(4)将煤加工处理的意义是
您最近一年使用:0次
2020-02-27更新
|
220次组卷
|
2卷引用:福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期中考试化学试题
解题方法
3 . 氢能作为新型能源,可利用CO制得.北京大学马丁教授等团队向容积为VL的密闭容器中充入等物质的量的CO和H2O进行反应。
已知:
反应Ⅰ:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH1
Fe(s)+CO2(g) ΔH1
反应Ⅱ:FeO(s)+H2(g) Fe(s)+H2O(g) ΔH2
Fe(s)+H2O(g) ΔH2
反应Ⅲ:CO(g)+H2O(g) CO2(g)+H2(g) ΔH
CO2(g)+H2(g) ΔH
反应Ⅲ在不同催化剂作用下(反应相同时间),温度与CO转化率的关系如图所示。

(1)反应Ⅲ的ΔH与ΔH1、ΔH2关系式:ΔH=_ 。
(2)若反应Ⅰ和反应Ⅱ的平衡常数分别为K1和K2,则反应Ⅲ的平衡常数K与K1、K2的关系式:K=___ 。
(3)随着温度的升高,CO的转化率先升后降,“后降”的可能原因是__ 。
(4)由图可知,ΔH__ 0(填“大于”或“小于”),催化剂应选择_ (填“Au/α-MoC”或“Au/α-MoC/NaCN”)。
(5)已知T=1025K时,K=1。则平衡时CO的转化率α(0)=__ 。当T>1025K时,平衡时,H2的体积分数ω的取值范围为_ 。此时,CO还原FeO(s)的能力__ H2(填“大于”或“小于”)。
(6)欲提高H2的体积分数,可采取的措施为__ 。
已知:
反应Ⅰ:FeO(s)+CO(g)
 Fe(s)+CO2(g) ΔH1
Fe(s)+CO2(g) ΔH1反应Ⅱ:FeO(s)+H2(g)
 Fe(s)+H2O(g) ΔH2
Fe(s)+H2O(g) ΔH2反应Ⅲ:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH
CO2(g)+H2(g) ΔH反应Ⅲ在不同催化剂作用下(反应相同时间),温度与CO转化率的关系如图所示。

(1)反应Ⅲ的ΔH与ΔH1、ΔH2关系式:ΔH=
(2)若反应Ⅰ和反应Ⅱ的平衡常数分别为K1和K2,则反应Ⅲ的平衡常数K与K1、K2的关系式:K=
(3)随着温度的升高,CO的转化率先升后降,“后降”的可能原因是
(4)由图可知,ΔH
(5)已知T=1025K时,K=1。则平衡时CO的转化率α(0)=
(6)欲提高H2的体积分数,可采取的措施为
您最近一年使用:0次
解题方法
4 . 二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题。
Ⅰ.CO2可以与H2反应合成C2H4,该转化分两步进行:
第一步:CO2(g)+H2(g) CO(g)+H2O(g)△H=+41.3kJ·mol-1
CO(g)+H2O(g)△H=+41.3kJ·mol-1
第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g)△H=–210.5kJ·mol-1
C2H4(g)+2H2O(g)△H=–210.5kJ·mol-1
(1)CO2与H2反应反应合成乙烯的热化学方程式为___ 。
(2)一定条件下的密闭容器中,要提高CO2合成乙烯的转化率,可以采取的措施是____ (填标号)。
①减小压强②增大H2的浓度③加入适当催化剂④分离出H2O(g)
(3)已知温度对CO2合成乙烯的平衡转化率及催化剂的催化效率的影响如图所示,下列说法正确的是____ (填标号)。

①N点的速率最大
②M点的平衡常数比N点的平衡常数大
③温度低于250℃时,随温度升高乙烯的平衡产率增大
④实际反应尽可能在较低的温度下进行,以提高CO2的转化率
Ⅱ.研究表明CO2和H2在一定条件下可以合成甲醇,反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0molCO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0molCO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:

(4)催化效果最佳的是催化剂____ (填“A”、“B”或“C”)。
(5)T2温度下,若反应进行10min达到图中a点状态,用CO2的浓度表示的反应速率v(CO2)=____ 。
(6)图中b点已达平衡状态,则该温度下反应的平衡常数K=____ 。
(7)在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应:CO2(g)+H2(g) CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。表中数据说明,升高温度CO2的实际转化率提高而甲醇的选择性降低,其原因是____ 。
Ⅰ.CO2可以与H2反应合成C2H4,该转化分两步进行:
第一步:CO2(g)+H2(g)
 CO(g)+H2O(g)△H=+41.3kJ·mol-1
CO(g)+H2O(g)△H=+41.3kJ·mol-1第二步:2CO(g)+4H2(g)
 C2H4(g)+2H2O(g)△H=–210.5kJ·mol-1
C2H4(g)+2H2O(g)△H=–210.5kJ·mol-1(1)CO2与H2反应反应合成乙烯的热化学方程式为
(2)一定条件下的密闭容器中,要提高CO2合成乙烯的转化率,可以采取的措施是
①减小压强②增大H2的浓度③加入适当催化剂④分离出H2O(g)
(3)已知温度对CO2合成乙烯的平衡转化率及催化剂的催化效率的影响如图所示,下列说法正确的是

①N点的速率最大
②M点的平衡常数比N点的平衡常数大
③温度低于250℃时,随温度升高乙烯的平衡产率增大
④实际反应尽可能在较低的温度下进行,以提高CO2的转化率
Ⅱ.研究表明CO2和H2在一定条件下可以合成甲醇,反应方程式为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0molCO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0molCO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
(4)催化效果最佳的是催化剂
(5)T2温度下,若反应进行10min达到图中a点状态,用CO2的浓度表示的反应速率v(CO2)=
(6)图中b点已达平衡状态,则该温度下反应的平衡常数K=
(7)在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应:CO2(g)+H2(g)
 CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:| T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
您最近一年使用:0次
解题方法
5 . 化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺如下:

(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=____ kJ/mol
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题
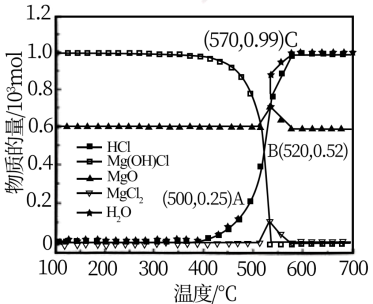
①应选择的最佳反应温度是___________
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=___________ (Kp为以分压表示的平衡常数)
③结合平衡移动原理,原料气增加水蒸气的目的是___________
(3)“氯乙烯反应”中, (g)+HCl(g)
(g)+HCl(g)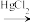 CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
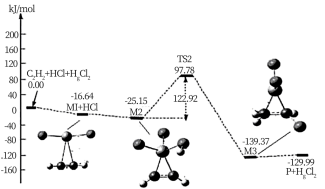
①碳碳叁键的键能:M1_____  (填“>”或“<”)
(填“>”或“<”)
②“M2→M3”的化学方程式为__________
③该反应的决速步骤为__________
(4)下列有关该工艺的说法不正确的是______ (填标号)
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗

(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题

①应选择的最佳反应温度是
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=
③结合平衡移动原理,原料气增加水蒸气的目的是
(3)“氯乙烯反应”中,
 (g)+HCl(g)
(g)+HCl(g) CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
①碳碳叁键的键能:M1
 (填“>”或“<”)
(填“>”或“<”)②“M2→M3”的化学方程式为
③该反应的决速步骤为
(4)下列有关该工艺的说法不正确的是
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗
您最近一年使用:0次
6 . 二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________ (用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________ 2ΔH2+ΔH3 (填“>”、<”或“=”)。
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____ V逆(填“>”、“<”或“=”)。

③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________ (填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________ 。
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________ 。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________ g(设电池的能量利用率为50%)。
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向
| 物质 | CH3OH | CH3OCH3 | H2O |
| 分压/MPa | 0.50 | 0.50 | 0.50 |
此时正、逆反应速率的大小:V正

③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为
您最近一年使用:0次
2020-01-29更新
|
193次组卷
|
2卷引用:福建省泉州市2020届普通高中毕业班单科质量检查化学试题
解题方法
7 . 废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。为研究不同pH下用NaClO氧化废水中的氨氮(用硝酸铵模拟),使其转化为无污染的气体,试剂用量如下表。已知:HClO的氧化性比ClO—的氧化性更强。下列说法错误的是
| pH | 0.100mol/L NH4NO3(mL) | 0.100mol/L NaClO(mL) | 0.200mol/L H2SO4(mL) | 蒸馏水 (mL) | 氨氮去除 率(%) |
| 1.0 | 10.00 | 10.00 | 10.00 | 10.00 | 89 |
| 2.0 | 10.00 | 10.00 | V1 | V2 | 75 |
| 6.0 | …… | …… | …… | …… | 85 |
| A.V1=2.00 |
| B.pH=1时发生反应:3ClO—+2NH4+=3Cl—+N2↑+3H2O+2H+ |
| C.pH从1升高到2,氨氮去除率降低的原因是更多的HClO转化为ClO— |
| D.pH控制在6时再进行处理更容易达到排放标准 |
您最近一年使用:0次
2020-01-29更新
|
172次组卷
|
2卷引用:福建省泉州市2020届普通高中毕业班单科质量检查化学试题
8 . MoS2(s)(辉钼矿的主要成分可用于制取钼的化合物、润滑添加剂、氢化反应和异构化反应的催化剂等,回答下列问题:
(1)已知:MoS2(s)=Mo(s)+S2(g) △H1;
S2(g)+2O2(g)=2SO2(g) △H2;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H3;;
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=______ 用含△H1、△H2、△H3的代数式表示
(2)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液装置如图所示。
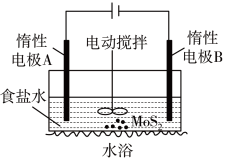
①阴极的电极反应式为__________ 。
②MoO42-在电极______ (填A或B)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________ 。
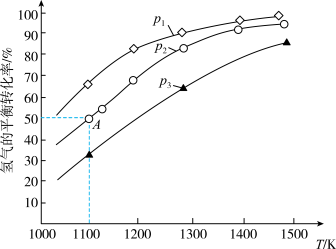
(3)用辉钼矿冶炼Mo的反应为MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H______ 0(填“>”或“<”);p1、p2、p3按从小到大的顺序为______________ 。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若充入氦气,平衡________ (填“向正反应方向”“向逆反应方向”或“不移动”)。
(5)在2L的恒温恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为______ 。
(1)已知:MoS2(s)=Mo(s)+S2(g) △H1;
S2(g)+2O2(g)=2SO2(g) △H2;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H3;;
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=
(2)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液装置如图所示。

①阴极的电极反应式为
②MoO42-在电极
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是
(3)用辉钼矿冶炼Mo的反应为MoS2(s)+4H2(g)+2Na2CO3(s)
 Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若充入氦气,平衡
(5)在2L的恒温恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为

您最近一年使用:0次
名校
解题方法
9 . 1,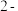 二氯丙烷
二氯丙烷 是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为
是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为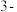 氯丙烯
氯丙烯 ,反应原理为:
,反应原理为:
Ⅰ
 CH2ClCHClCH3(g) ∆H1= -134KJ/mol-1
CH2ClCHClCH3(g) ∆H1= -134KJ/mol-1
Ⅱ
 CH2=CHCH2Cl(g)+HCl(g) ∆H2= -102KJ/mol-1
CH2=CHCH2Cl(g)+HCl(g) ∆H2= -102KJ/mol-1
请回答下列问题:
 已知
已知

 的活化能
的活化能 正
正 为132KJ/mol-1,则该反应的活化能
为132KJ/mol-1,则该反应的活化能 逆
逆 为
为__________ KJ/mol-1。
 一定温度下,向恒容密闭容器中充入等物质的量的
一定温度下,向恒容密闭容器中充入等物质的量的 和
和 ,在催化剂作用下发生反应Ⅰ、Ⅱ,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应Ⅰ、Ⅱ,容器内气体的压强随时间的变化如下表所示。
①若用单位时间内气体分压的变化来表示反应速率,即ν= ,则前
,则前 内平均反应速率ν(CH2ClCHClCH3)=
内平均反应速率ν(CH2ClCHClCH3)=__________ kPa∙min-1(保留小数点后2位 。
。
②该温度下,若平衡时HCl的体积分数为 ,则丙烯的平衡总转化率α=
,则丙烯的平衡总转化率α=__________ ;反应Ⅰ的平衡常数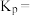
________  为以分压表示的平衡常数,保留小数点后2位
为以分压表示的平衡常数,保留小数点后2位 。
。
 某研究小组向密闭容器中充入一定量的
某研究小组向密闭容器中充入一定量的 和
和 ,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得
,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。

下列说法错误的是____________  填代号
填代号 。
。
 使用催化剂A的最佳温度约为250℃
使用催化剂A的最佳温度约为250℃
 相同条件下,改变压强会影响
相同条件下,改变压强会影响 的产率
的产率
c. 点是对应温度下
点是对应温度下 的平衡产率
的平衡产率
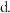 提高
提高 反应选择性的关键因素是控制温度
反应选择性的关键因素是控制温度
(4)在四个恒容密闭容器中充入相应量的气体(如图):

发生反应2N2O(g) 2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:
2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:

容器II、Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率:
① 正(N2O)
正(N2O)____ 逆(N2O)。(填“>”“<”或“=”)
②图中A、B、C三点处容器内密度最大的点是____ (填“A”“B”或“C”)。
 二氯丙烷
二氯丙烷 是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为
是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为 氯丙烯
氯丙烯 ,反应原理为:
,反应原理为:Ⅰ

 CH2ClCHClCH3(g) ∆H1= -134KJ/mol-1
CH2ClCHClCH3(g) ∆H1= -134KJ/mol-1Ⅱ

 CH2=CHCH2Cl(g)+HCl(g) ∆H2= -102KJ/mol-1
CH2=CHCH2Cl(g)+HCl(g) ∆H2= -102KJ/mol-1请回答下列问题:
 已知
已知

 的活化能
的活化能 正
正 为132KJ/mol-1,则该反应的活化能
为132KJ/mol-1,则该反应的活化能 逆
逆 为
为 一定温度下,向恒容密闭容器中充入等物质的量的
一定温度下,向恒容密闭容器中充入等物质的量的 和
和 ,在催化剂作用下发生反应Ⅰ、Ⅱ,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应Ⅰ、Ⅱ,容器内气体的压强随时间的变化如下表所示。时间 | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强 | 80 |
|
|
|
|
|
|
①若用单位时间内气体分压的变化来表示反应速率,即ν=
 ,则前
,则前 内平均反应速率ν(CH2ClCHClCH3)=
内平均反应速率ν(CH2ClCHClCH3)= 。
。②该温度下,若平衡时HCl的体积分数为
 ,则丙烯的平衡总转化率α=
,则丙烯的平衡总转化率α=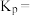
 为以分压表示的平衡常数,保留小数点后2位
为以分压表示的平衡常数,保留小数点后2位 。
。 某研究小组向密闭容器中充入一定量的
某研究小组向密闭容器中充入一定量的 和
和 ,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得
,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
下列说法错误的是
 填代号
填代号 。
。 使用催化剂A的最佳温度约为250℃
使用催化剂A的最佳温度约为250℃ 相同条件下,改变压强会影响
相同条件下,改变压强会影响 的产率
的产率c.
 点是对应温度下
点是对应温度下 的平衡产率
的平衡产率 提高
提高 反应选择性的关键因素是控制温度
反应选择性的关键因素是控制温度(4)在四个恒容密闭容器中充入相应量的气体(如图):

发生反应2N2O(g)
 2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:
2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:
容器II、Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率:
①
 正(N2O)
正(N2O)②图中A、B、C三点处容器内密度最大的点是
您最近一年使用:0次
10 . 《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加 德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是

零价铁活化过硫酸钠去除废水中As(V)的机制模型

零价铁活化过硫酸钠去除废水中As(V)的机制模型
| A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键 |
B.若56g Fe参加反应,共有NA个 被还原 被还原 |
| C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为1×10-10mol·L-1 |
| D.pH越小,越有利于去除废水中的正五价砷 |
您最近一年使用:0次
2020-01-04更新
|
287次组卷
|
3卷引用:福建省厦门外国语学校2020届高三12月月考化学试题