河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
河南
高二
阶段练习
2020-12-27
225次
整体难度:
适中
考查范围:
化学与STSE、化学反应原理、认识化学科学、有机化学基础
河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
河南
高二
阶段练习
2020-12-27
225次
整体难度:
适中
考查范围:
化学与STSE、化学反应原理、认识化学科学、有机化学基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. “天问一号”火星探测器正在奔赴火星的路上,发射该探测器的长征五号遥四火箭使用的是两种推进剂组合液:液氧/煤油和液氧/液氢。下列说法错误的是


| A.煤油是一种化石燃料 |
| B.煤油和氢气均是一次能源 |
| C.氢气是比煤油更清洁的能源 |
| D.煤油不完全燃烧会产生C和CO等污染物 |
您最近一年使用:0次
2020-12-20更新
|
83次组卷
|
2卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
单选题
|
容易(0.94)
2. 下列反应的△H<0、△S>0的是
| A.CO2(g)+C(s)=2CO(g) | B.2Na(s)+2H2O(l)=2Na+(aq)+2OH-(aq)+H2(g) |
C.N2(g)+3H2(g) 2NH3(g) 2NH3(g) | D.C(s)+H2O(g) CO(g)+H2(g) CO(g)+H2(g) |
【知识点】 化学反应进行方向的判据
您最近一年使用:0次
2020-12-20更新
|
614次组卷
|
4卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题(已下线)2.4 化学反应进行的方向-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第28练 化学反应的方向-2023年高考化学一轮复习小题多维练(全国通用)辽宁省葫芦岛市第八高级中学2021–2022学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
3. 下列反应的平衡常数的表达式错误的是
A.C(s)+H2O(g) CO(g)+H2(g) K= CO(g)+H2(g) K=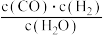 |
B.SO3(g) SO2(g)+ SO2(g)+ O2(g) K= O2(g) K= |
C.I-(aq)+AgCl(s) AgI(s)+Cl-(aq) K= AgI(s)+Cl-(aq) K=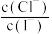 |
D.Cl2(g)+H2O(l) HCl(aq)+HClO(aq) K= HCl(aq)+HClO(aq) K= |
【知识点】 化学平衡常数的概念及表达方式解读
您最近一年使用:0次
2020-12-20更新
|
935次组卷
|
9卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(理)试题(已下线)2.2.2 化学平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)安徽省肥东凯悦中学2021-2022学年高二上学期第一次月考化学试题(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)海南省文昌中学2022-2023学年高二上学期第一次月考化学试题浙江省海盐第二高级中学2022-2023学年高二上学期10月第一阶段检测化学试题【精品卷】2.2.2 化学平衡常数课堂例题-人教版2023-2024学年选择性必修1【定心卷】2.2.2 化学平衡常数随堂练习-人教版2023-2024学年选择性必修1
单选题
|
适中(0.65)
4. 下列事实不能说明HCOOH是弱酸的是
| A.HCOONa溶液呈碱性 |
| B.25℃时,0.1 mol·L-1 HCOOH溶液的pH=2.38 |
| C.25℃时,pH=3的HCOOH溶液稀释10倍后pH为b且3<b<4 |
| D.中和50.00 mL 0.1000 mol·L-1 HCOOH溶液需消耗0.2000 mol·L-1 NaOH溶液25.00 mL |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
5. 用锡箔与3 mol·L-1盐酸制SnCl2的反应速率较慢,下列措施不能加快反应速率的是
| A.将反应液适当加热 | B.向反应液中滴入少量CuCl2溶液 |
| C.用锡块代替锡箔 | D.用浓盐酸代替3 mol·L-1盐酸 |
您最近一年使用:0次
单选题
|
较易(0.85)
6. 反应CH4(g)+NH3(g) HCN(g)+3H2(g) △H>0,下列有利于提高NH3平衡转化率的是
HCN(g)+3H2(g) △H>0,下列有利于提高NH3平衡转化率的是
 HCN(g)+3H2(g) △H>0,下列有利于提高NH3平衡转化率的是
HCN(g)+3H2(g) △H>0,下列有利于提高NH3平衡转化率的是| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
【知识点】 化学平衡的移动及其影响因素 勒夏特列原理的应用解读
您最近一年使用:0次
2020-12-20更新
|
78次组卷
|
2卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
单选题
|
较易(0.85)
7. 已知CH3CH2CH=CH2(沸点:4℃)、(CH3)2C=CH2(沸点:-6.9℃)的燃烧热(ΔH)依次为-2719.1 kJ·mol-1、-2705.3 kJ·mol-1。下列叙述或热化学方程式正确的是
| A.CH3CH2CH=CH2比(CH3)2C=CH2稳定 |
| B.CH3CH2CH=CH2(g)+6O2(g)=4CO2(g)+4H2O(g) ΔH=-2719.1 kJ·mol-1 |
| C.CH3CH2CH=CH2(g)+4O2(g)=4CO(g)+4H2O(1) ΔH=-2719.1 kJ·mol-1 |
| D.(CH3)2C=CH2(g)+6O2(g)=4CO2(g)+4H2O(1) ΔH=-2705.3 kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
8. 某恒温恒容密闭容器中进行反应2C(s)+H2(g)+N2(g) 2HCN(g),下列状态能说明该反应已达到平衡状态的是
2HCN(g),下列状态能说明该反应已达到平衡状态的是
 2HCN(g),下列状态能说明该反应已达到平衡状态的是
2HCN(g),下列状态能说明该反应已达到平衡状态的是| A.混合气体的压强不再随时间变化 |
| B.混合气体的密度不再随时间变化 |
| C.v(H2)正:v(N2)正:v(HCN)正=1:1:2 |
| D.单位时间内断裂H-H键数目与断裂C-H键数目相等 |
【知识点】 化学平衡状态本质及特征解读 化学平衡状态的判断方法解读
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
9. 室温下,下列四组离子在指定条件下能大量共存的是
A.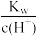 =0.1mol∙L-1的溶液:K+、Al3+、 =0.1mol∙L-1的溶液:K+、Al3+、 、Cl- 、Cl- |
| B.能使甲基橙显红色的溶液:Na+、Ca2+、Cl-、CH3COO- |
C.c(FeCl3)=0.1mol∙L-1的溶液:H+、Cu2+、 、 、 |
D.由水电离产生的c(OH-)=1×10-13mol∙L-1的溶液:K+、 、 、 、ClO- 、ClO- |
【知识点】 离子共存 物质共存解读 限定条件下的离子共存解读 生活中常见物质的酸碱性解读
您最近一年使用:0次
2020-12-20更新
|
180次组卷
|
4卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
单选题
|
适中(0.65)
名校
解题方法
10. 1,3-丁二烯( )与HBr加成的能量与反应历程关系如图所示。下列说法错误的是
)与HBr加成的能量与反应历程关系如图所示。下列说法错误的是
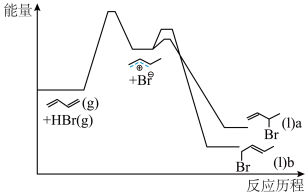
 )与HBr加成的能量与反应历程关系如图所示。下列说法错误的是
)与HBr加成的能量与反应历程关系如图所示。下列说法错误的是
| A.b比a稳定 | B.a、b互为同分异构体 |
| C.生成a和b的反应均为放热反应 | D.反应生成a的速率比b的慢 |
您最近一年使用:0次
2020-12-20更新
|
328次组卷
|
5卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
单选题
|
适中(0.65)
11. 下列实验过程不能达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 排除碱式滴定管尖嘴处气泡 | 使尖嘴垂直向下,轻轻挤压橡胶管中玻璃球,使部分液体流出 |
| B | 配制FeCl3溶液 | 将FeCl3溶于较浓的盐酸中,然后加水稀释 |
| C | 探究盐类的水解反应为吸热反应 | 向盛有Na2CO3溶液的试管中滴入酚酞,然后微热,观察溶液颜色变化 |
| D | 探究浓度对反应速率的影响 | 向分别盛有2 mL0.1 mol/L、2 mL0.2 mol/L H2C2O4溶液的两支试管中同时加入4 mL0.01 mol/ L酸性KMnO4溶液,观察实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-20更新
|
145次组卷
|
3卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
单选题
|
适中(0.65)
12. 常温下,在恒容密闭容器中进行合成氨反应N2(g)+3H2(g) 2NH3(g),下列有关叙述正确的是
2NH3(g),下列有关叙述正确的是
 2NH3(g),下列有关叙述正确的是
2NH3(g),下列有关叙述正确的是| A.维持温度、压强一定,加入催化剂,N2的平衡转化率增大 |
| B.向平衡体系中充入少量D2,达到新平衡时,容器中存在H-D键和N-D键 |
| C.增大平衡体系的压强,平衡正向移动,该反应的平衡常数增大 |
| D.0.1 mol N2与0.3 mol H2在密闭容器中充分反应,放出a kJ的热量,则该反应的△H=-10a kJ·mol-1 |
您最近一年使用:0次
2020-12-20更新
|
90次组卷
|
2卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
单选题
|
适中(0.65)
13. 室温下,下列有关电解质溶液的叙述正确的是
A.相同浓度的氨水与NH4Cl溶液等体积混合后溶液的pH>7,则混合溶液中:c( )>c(Cl-) )>c(Cl-) |
| B.0.3 mol·L-1 CH3COOH溶液中c(CH3COO-)是0.1 mol·L-1 CH3COOH溶液中c(CH3COO-)的3倍 |
C.NaNH4HPO4溶液中:c(Na+)+c( )+c(H+)=c( )+c(H+)=c( )+c( )+c( )+c( )+c( )+c(OH-) )+c(OH-) |
| D.向均盛有2 mL 3 mol·L-1 NaOH溶液的两支试管中分别加入2滴浓度均为1 mol·L-1的MgCl2、AlCl3溶液,只有前者有白色沉淀产生,则Ksp[Mg(OH)2]<Ksp[Al(OH)3] |
您最近一年使用:0次
14. 298 K、101 kPa时,根据6C(石墨,s)+3H2(g)=C6H6(l)设计的反应路径如下:

上述条件下石墨、氢气、苯的燃烧热依次为△H(石墨)、△H(H2)、△H(C6H6),下列说法正确的是

上述条件下石墨、氢气、苯的燃烧热依次为△H(石墨)、△H(H2)、△H(C6H6),下列说法正确的是
| A.△H1=△H2+△H3 |
| B.C6H6的能量一定高于CO2和H2O的能量 |
| C.1 mol C6H6(g)完全燃烧生成CO2(g)和H2O(l)的△H>△H3 |
| D.6×△H(石墨)+3×△H(H2)=△H2 |
您最近一年使用:0次
2020-12-20更新
|
228次组卷
|
3卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题(已下线)第25练 反应热的计算-2023年高考化学一轮复习小题多维练(全国通用)安徽省芜湖市第一中学2021-2022学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
15. 室温下,用0.1000 mol·L-1盐酸滴定100 mL 0.1000 mol·L-1氨水,滴定曲线如图所示。下列说法正确的是


| A.lgKb(NH3·H2O)=-9.26 | B.最适宜用酚酞作指示剂 |
| C.a点,lgc(OH-)≈-2.87 | D.溶液在b点和c点时水的电离程度相同 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
16. 在某密闭容器中发生反应CO(g)+Cl2(g) COCl2(g)(△H<0),其中各物质的浓度随时间的变化如图所示(t1、t2、t3均只改变一个条件)。下列叙述错误的是
COCl2(g)(△H<0),其中各物质的浓度随时间的变化如图所示(t1、t2、t3均只改变一个条件)。下列叙述错误的是

 COCl2(g)(△H<0),其中各物质的浓度随时间的变化如图所示(t1、t2、t3均只改变一个条件)。下列叙述错误的是
COCl2(g)(△H<0),其中各物质的浓度随时间的变化如图所示(t1、t2、t3均只改变一个条件)。下列叙述错误的是
| A.0~10s内,CO的平均反应速率为0.08 mol·L-1·s-1 |
| B.t1时改变的条件是充入CO气体 |
| C.t2时改变的条件是降低体系温度 |
| D.平衡常数K:①=②=③>④ |
【知识点】 化学平衡图像分析 化学平衡常数的影响因素及应用解读
您最近一年使用:0次
2020-12-20更新
|
104次组卷
|
4卷引用:河南省重点高中2020-2021学年高二上学期阶段性测试(二) 化学试题
二、计算题 添加题型下试题
计算题
|
适中(0.65)
解题方法
17. 在恒压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101 kPa时,1 g氨气完全燃烧放出18.6 kJ的热量,则4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=______ kJ·mol-1。
(2)常压下,某铝热反应的温度与能量变化如图所示:
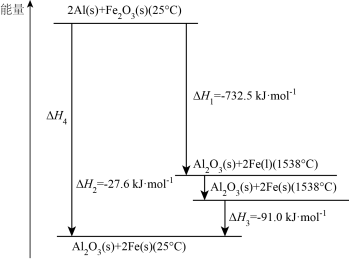
①常压、1538℃时,Fe(s)→Fe(l) △H=______ kJ·mol-1。
②常压、25℃时,该铝热反应的热化学方程式为__________ 。
(3)在稀溶液中酸与碱发生中和反应生成1 mol水时所释放的热量称为中和热。部分酸与碱反应的中和热如下表:
①I、IV的热化学方程式(用离子方程式形式表示)依次为_____ 、_____ 。
②I、II的△H相同,III、IV、V的△H比I、II大,其原因是__________ 。
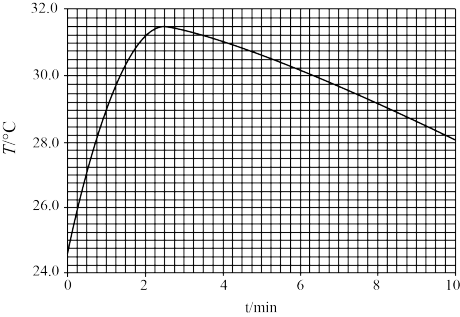
③体积和浓度均为25.0 mL 1.00 mol·L-1的硝酸和NaOH溶液(起始温度相同)混合时,测得混合溶液的温度与时间的关系如图所示,已知硝酸和NaOH溶液的密度均为1.00 g·mL-1,混合溶液的比热容为4.18 J·g-1·℃-1。由实验数据可计算出该反应的中和热△H为______ kJ·mol-1(结果保留1位小数)。
(1)25℃、101 kPa时,1 g氨气完全燃烧放出18.6 kJ的热量,则4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=
(2)常压下,某铝热反应的温度与能量变化如图所示:

①常压、1538℃时,Fe(s)→Fe(l) △H=
②常压、25℃时,该铝热反应的热化学方程式为
(3)在稀溶液中酸与碱发生中和反应生成1 mol水时所释放的热量称为中和热。部分酸与碱反应的中和热如下表:
| 组别 | 酸与碱 | 中和热△H/(kJ/mol) |
| Ⅰ | HCl+NaOH | -57.1 |
| Ⅱ | HNO3+KOH | -57.1 |
| Ⅲ | CH3COOH+NaOH | -56.1 |
| Ⅳ | HCl+NH3·H2O | -53.4 |
| Ⅴ | CH3COOH+NH3·H2O | -50.4 |
②I、II的△H相同,III、IV、V的△H比I、II大,其原因是
③体积和浓度均为25.0 mL 1.00 mol·L-1的硝酸和NaOH溶液(起始温度相同)混合时,测得混合溶液的温度与时间的关系如图所示,已知硝酸和NaOH溶液的密度均为1.00 g·mL-1,混合溶液的比热容为4.18 J·g-1·℃-1。由实验数据可计算出该反应的中和热△H为

您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.65)
18. 铵盐是实验室常用试剂。回答下列问题:
(1)NH4Cl溶液中 水解的离子方程式为
水解的离子方程式为_____ ;加入镁粉可产生大量气体,该气体的成分是______ (写化学式)。
(2)物质的量浓度相同的下列四种铵盐的溶液中,c( )从大到小的顺序为
)从大到小的顺序为______ (用标号表示)。
A.(NH4)2CO3 B.CH3COONH4 C.NH4HSO4 D.NH4Cl
(3)少量Mg(OH)2能溶于CH3COONH4浓溶液(呈中性)的原因是______ (用文字和方程式说明)。
(4)甲醛法测定铵盐中氮的质量分数的实验步骤如下:步骤I.称取a g (NH4)2SO4样品,用水溶解后定容于250 mL容量瓶中;步骤II.取出25.00 mL溶液于锥形瓶中,加入足量中性甲醛溶液[4 +6HCHO=3H++6H2O+(CH2)6N4H+],再加入酚酞指示剂,用c mol·L-1 NaOH标准溶液滴定[3H++(CH2)6N4H++4OH-=(CH2)6N4+4H2O],滴定到终点时消耗标准溶液V mL。
+6HCHO=3H++6H2O+(CH2)6N4H+],再加入酚酞指示剂,用c mol·L-1 NaOH标准溶液滴定[3H++(CH2)6N4H++4OH-=(CH2)6N4+4H2O],滴定到终点时消耗标准溶液V mL。
①滴定到终点时,溶液颜色的变化是__________ 。
②该(NH4)2SO4样品中氮的质量分数为______ (用含a、c、V的代数式表示)。
③推测下列铵盐中不能用该法测定其中氮的质量分数的是______ (填标号)。
A.NH4Cl B.NH4HCO3 C.NH4NO3 D.CH3COONH4
(1)NH4Cl溶液中
 水解的离子方程式为
水解的离子方程式为(2)物质的量浓度相同的下列四种铵盐的溶液中,c(
 )从大到小的顺序为
)从大到小的顺序为A.(NH4)2CO3 B.CH3COONH4 C.NH4HSO4 D.NH4Cl
(3)少量Mg(OH)2能溶于CH3COONH4浓溶液(呈中性)的原因是
(4)甲醛法测定铵盐中氮的质量分数的实验步骤如下:步骤I.称取a g (NH4)2SO4样品,用水溶解后定容于250 mL容量瓶中;步骤II.取出25.00 mL溶液于锥形瓶中,加入足量中性甲醛溶液[4
 +6HCHO=3H++6H2O+(CH2)6N4H+],再加入酚酞指示剂,用c mol·L-1 NaOH标准溶液滴定[3H++(CH2)6N4H++4OH-=(CH2)6N4+4H2O],滴定到终点时消耗标准溶液V mL。
+6HCHO=3H++6H2O+(CH2)6N4H+],再加入酚酞指示剂,用c mol·L-1 NaOH标准溶液滴定[3H++(CH2)6N4H++4OH-=(CH2)6N4+4H2O],滴定到终点时消耗标准溶液V mL。①滴定到终点时,溶液颜色的变化是
②该(NH4)2SO4样品中氮的质量分数为
③推测下列铵盐中不能用该法测定其中氮的质量分数的是
A.NH4Cl B.NH4HCO3 C.NH4NO3 D.CH3COONH4
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
19. 硫化物是自然界硫循环中的重要物质。回答下列问题:
(1)反应2H2S(g)=2H2(g)+S2(g) △H>0在______ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)闪锌矿转化为CuS矿的反应为ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq),该反应的平衡常数K=__________ [用含Ksp(CuS)、Ksp(ZnS)的代数式表示]。
(3)25℃时,某混合溶液中c(H2S)+c(HS-)+c(S2-)=0.01 mol·L-1,Ka1、Ka2分别为H2S的一级电离常数和二级电离常数;lgc(H2S)、lgc(HS-)、lgc(S2-)随pH变化的关系如图所示:

①在水溶液中H2S的电离方程式为__________ 、__________ 。
②图中c表示的含硫微粒是____________ (填离子符号)。
③H2S的Ka1=______ mol·L-1。
④图中M点的pH=______ (用含lgKa1、lgKa2的代数式表示)。
(1)反应2H2S(g)=2H2(g)+S2(g) △H>0在
(2)闪锌矿转化为CuS矿的反应为ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq),该反应的平衡常数K=
(3)25℃时,某混合溶液中c(H2S)+c(HS-)+c(S2-)=0.01 mol·L-1,Ka1、Ka2分别为H2S的一级电离常数和二级电离常数;lgc(H2S)、lgc(HS-)、lgc(S2-)随pH变化的关系如图所示:

①在水溶液中H2S的电离方程式为
②图中c表示的含硫微粒是
③H2S的Ka1=
④图中M点的pH=
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
较易(0.85)
解题方法
20. 自热化学链重整制氢CLR(a)工艺的原理如图所示:
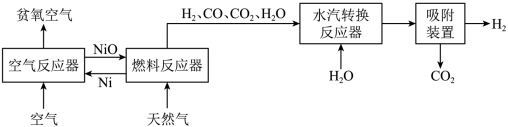
回答下列问题:
(1)25℃、101 kPa时,1.0 g Ni与足量O2反应生成NiO放出8.0 kJ的热量,则在“空气反应器”中发生反应的热化学方程式为_______________ 。
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) △H1=-47.0 kJ∙mol−1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) △H2=+137.7 kJ∙mol−1
(III)CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=+225.5 kJ∙mol−1
则反应CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)的△H=______ kJ∙mol−1。
(3)“水汽转换反应器”中发生的反应为CO(g)+H2O(g) H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正)
H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正) ______ υ(逆)(填“>”“=”或“<”),理由是__________ 。
(4)甲烷制氢传统工艺有水蒸气重整、部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+192 kJ∙mol−1
部分氧化重整反应:CH4(g)+O2(g)=CO2(g)+2H2(g) △H=-748 kJ∙mol−1
采用水蒸气重整的优点是__________ ;若上述两个反应在保持自热条件下(假设无热量损失),理论上1 mol CH4至多可获得H2的物质的量为____________ (结果保留1位小数)。

回答下列问题:
(1)25℃、101 kPa时,1.0 g Ni与足量O2反应生成NiO放出8.0 kJ的热量,则在“空气反应器”中发生反应的热化学方程式为
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) △H1=-47.0 kJ∙mol−1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) △H2=+137.7 kJ∙mol−1
(III)CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=+225.5 kJ∙mol−1
则反应CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)的△H=
(3)“水汽转换反应器”中发生的反应为CO(g)+H2O(g)
 H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正)
H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正) (4)甲烷制氢传统工艺有水蒸气重整、部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+192 kJ∙mol−1
部分氧化重整反应:CH4(g)+O2(g)=CO2(g)+2H2(g) △H=-748 kJ∙mol−1
采用水蒸气重整的优点是
您最近一年使用:0次
六、解答题 添加题型下试题
解答题-原理综合题
|
较难(0.4)
21. CH3OH是一种重要的化工原料,可由CO或CO2与H2反应合成,在密闭容器内发生的主要反应如下,其平衡常数的自然对数ln Kp(Kp是以分压表示的平衡常数,分压=总压×物质的量分数)随温度的变化如图所示:
I.CO(g)+2H2(g) CH3OH(g) Kp(I)
CH3OH(g) Kp(I)
II.CO2(g)+3H2(g) CH3OH(g)+H2O(g) Kp(II)
CH3OH(g)+H2O(g) Kp(II)
III.CO2(g)+H2(g) CO(g)+H2O(g) Kp(III)
CO(g)+H2O(g) Kp(III)
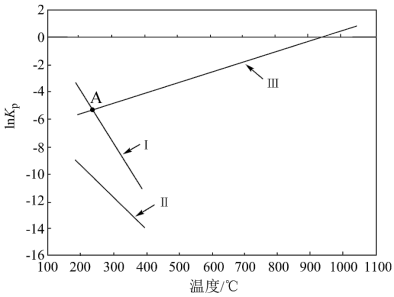
(1)ΔH>0的反应是______ (填标号)。
(2)反应III的Kp(III)=______ [用含Kp(I)、Kp(II)的代数式表示]。
(3)若图中A点时发生反应CH3OH(g)+CO2(g) 2CO(g)+H2(g)+H2O(g),则其lnKp=
2CO(g)+H2(g)+H2O(g),则其lnKp=______ (填数值)。
(4)在某催化剂催化和3.6×104 kPa下,由CO2和H2在密闭容器内合成甲醇,反应相同时间时,甲醇的选择性[S(CH3OH)]、CO2的转化率[X(CO2)]及CO的选择性[S(CO)]与温度的关系如图所示:
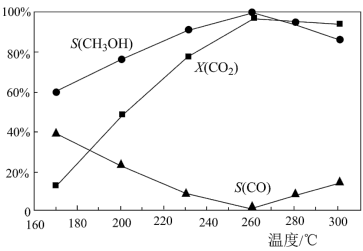
①实际生产中选择260℃的原因,除X(CO2)最大外,还有__________ 。
②温度高于260℃时,升高温度X(CO2)减小的原因是__________________ (从反应II、III的平衡移动角度分析)。
(5)某合成气只含CO、H2且n(CO):n(H2)=1:m,在温度t、压强p条件下在密闭容器内进行反应I,若CO平衡转化率为α,则平衡常数Kp(I)=____________ (用含m、α、p的代数式表示)。
I.CO(g)+2H2(g)
 CH3OH(g) Kp(I)
CH3OH(g) Kp(I)II.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) Kp(II)
CH3OH(g)+H2O(g) Kp(II)III.CO2(g)+H2(g)
 CO(g)+H2O(g) Kp(III)
CO(g)+H2O(g) Kp(III)
(1)ΔH>0的反应是
(2)反应III的Kp(III)=
(3)若图中A点时发生反应CH3OH(g)+CO2(g)
 2CO(g)+H2(g)+H2O(g),则其lnKp=
2CO(g)+H2(g)+H2O(g),则其lnKp=(4)在某催化剂催化和3.6×104 kPa下,由CO2和H2在密闭容器内合成甲醇,反应相同时间时,甲醇的选择性[S(CH3OH)]、CO2的转化率[X(CO2)]及CO的选择性[S(CO)]与温度的关系如图所示:

①实际生产中选择260℃的原因,除X(CO2)最大外,还有
②温度高于260℃时,升高温度X(CO2)减小的原因是
(5)某合成气只含CO、H2且n(CO):n(H2)=1:m,在温度t、压强p条件下在密闭容器内进行反应I,若CO平衡转化率为α,则平衡常数Kp(I)=
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、化学反应原理、认识化学科学、有机化学基础
试卷题型(共 21题)
题型
数量
单选题
16
计算题
1
填空题
2
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 化石能源 能源的充分利用 新能源的开发 一次能源与二次能源 | |
| 2 | 0.94 | 化学反应进行方向的判据 | |
| 3 | 0.85 | 化学平衡常数的概念及表达方式 | |
| 4 | 0.65 | 弱电解质的电离平衡 一元强酸与一元弱酸的比较 盐溶液的酸碱性判断 | |
| 5 | 0.65 | 影响化学反应速率的外因 影响化学反应速率的其他因素 原电池原理对化学反应速率的影响 | |
| 6 | 0.85 | 化学平衡的移动及其影响因素 勒夏特列原理的应用 | |
| 7 | 0.85 | 化学能与物质稳定性之间的关系 热化学方程式书写及正误判断 表示燃烧热的热化学方程式书写 | |
| 8 | 0.65 | 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 9 | 0.85 | 离子共存 物质共存 限定条件下的离子共存 生活中常见物质的酸碱性 | |
| 10 | 0.65 | 化学能与物质稳定性之间的关系 活化能及其对反应速率的影响 同分异构现象 | |
| 11 | 0.65 | 浓度对化学反应速率的影响 酸碱中和滴定实验基本操作及步骤 盐类水解的原理 易水解的盐溶液的配制 | |
| 12 | 0.65 | 反应热与焓变概念比较 化学平衡的移动及其影响因素 化学平衡常数的影响因素及应用 | |
| 13 | 0.65 | 浓度对电离平衡的影响 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 溶度积常数与溶解度的关系 | |
| 14 | 0.85 | 化学反应热的计算 热化学方程式书写及正误判断 燃烧热的计算 盖斯定律理解 | |
| 15 | 0.65 | 水溶液中水的电离程度及的计算 酸碱中和滴定指示剂选择 电离平衡常数及影响因素 | |
| 16 | 0.85 | 化学平衡图像分析 化学平衡常数的影响因素及应用 | |
| 二、计算题 | |||
| 17 | 0.65 | 化学反应热的计算 中和热的计算 燃烧热的计算 盖斯定律与热化学方程式 | |
| 三、填空题 | |||
| 18 | 0.65 | 酸碱中和滴定的综合考查 盐溶液中离子浓度大小的比较 沉淀的溶解与生成 | |
| 20 | 0.85 | 化学反应原理综合考查 盖斯定律与热化学方程式 盖斯定律的应用 化学平衡常数的有关计算 | |
| 四、解答题 | |||
| 19 | 0.65 | 复合判据 弱电解质在水溶液中的电离平衡 溶度积定义及表达式 弱电解质的电离平衡常数 | 原理综合题 |
| 21 | 0.4 | 温度对化学平衡移动的影响 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 外界条件对化学平衡影响的图像 | 原理综合题 |



