1 . 工业上除去电石渣浆 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:

下列说法正确的是
 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:
下列说法正确的是

A. 、 、 在过程Ⅰ、Ⅱ中均起催化剂作用 在过程Ⅰ、Ⅱ中均起催化剂作用 |
B.过程Ⅰ中,反应的离子方程式为 |
C.将10L上清液中的 转化为 转化为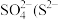 浓度为480 mg·L−1),理论上共需要0.03mol的 浓度为480 mg·L−1),理论上共需要0.03mol的 |
D.常温下,56gCaO溶于水配成1L溶液,溶液中 的数目为 的数目为 个 个 |
您最近半年使用:0次
2021-01-02更新
|
549次组卷
|
5卷引用:安徽省示范高中皖北协作区2020年第22届高三联考理科综合化学
安徽省示范高中皖北协作区2020年第22届高三联考理科综合化学(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)江西省南昌市新建区第二中学2019-2020学年高二下学期期终考试化学试题黑龙江省大庆实验中学实验一部2020-2021学年高一下学期开学考试化学试题湖北省龙泉中学、宜昌一中2021届高三下学期2月联合考试化学试题
19-20高三·江西南昌·期中
名校
2 . 硫酸盐(含SO 、HSO
、HSO )溶胶是”PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:
)溶胶是”PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:

下列说法正确的是( )
 、HSO
、HSO )溶胶是”PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:
)溶胶是”PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:
下列说法正确的是( )
| A.H2O没有参与该过程 | B.NO2是生成硫酸盐的还原剂 |
| C.硫酸盐气溶胶呈酸性 | D.该过程中没有共价键生成 |
您最近半年使用:0次
2020-12-07更新
|
578次组卷
|
5卷引用:【南昌新东方】3. 2020 高三 八一洪都期中联考 刘志平
(已下线)【南昌新东方】3. 2020 高三 八一洪都期中联考 刘志平福建省莆田市2021届高三毕业班第一次教学质量检测化学试卷江西省南昌县莲塘第一中学2020-2021学年高一下学期期中考试化学试题(已下线)热点10 新信息反应机理分析-2021年高考化学专练【热点·重点·难点】河南省洛阳创新发展联盟2023届高三摸底考试化学试题
名校
3 . 某兴趣小组探究Ba(OH)2溶液和 H2SO4溶液发生的是离子反应,设计的实验装置和实验测定的导电性曲线分别如图所示。下列有关说法错误的是
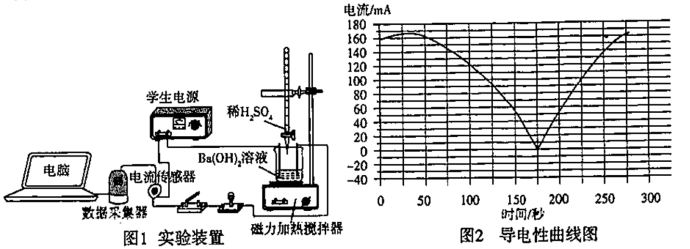

A.该反应的离子方程式是 Ba2+ +2OH- +SO +2H+=BaSO4↓+ 2H2O +2H+=BaSO4↓+ 2H2O |
| B.反应在经历大约270秒时,放出的热量也达到最大值。 |
| C.导电能力最低点表示 Ba(OH)2溶液和 H2SO4溶液恰好完全反应 |
| D.用盐酸代替H2SO4溶液,测得的导电性曲线和上述曲线相同 |
您最近半年使用:0次
2020-11-19更新
|
305次组卷
|
4卷引用:山东省潍坊市诸城一中2021届高三11月份模拟化学试题
山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)2.2.2 离子方程式的书写-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)湖南省长沙市雅礼中学2021 -2022学年上学期高一12月月考化学试题湖南省常德市临澧县第一中学2022-2023学年高一上学期第一次阶段性考试化学试题
4 . 氨在化肥生产、贮氢燃煤烟气脱硫脱硝等领域用途非常广泛。从能量的变化和反应的快慢等角度研究反应:N2+3H2 2NH3。请根据有关知识,填写下列空白:
2NH3。请根据有关知识,填写下列空白:
(1)为了加快反应速率,可以采取的措施有____________ 。
A.使用催化剂B.适当提高氮气的浓度C.适当提高反应的温度D.适当降低反应的温度
(2)从断键和成键的角度分析上述反应中能量的变化。根据下表数据,计算该反应生成1 mol NH3时放出_______ kJ的热量。
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。该生物燃料电池的总反应方程式为N2+3H2 2NH3。
2NH3。

①其中,右室电极为燃料电池的_____ 极,电池工作时电路中每转移0.3 mol电子,标准状况下消耗N2的体积是______ 。
②相比现有工业合成氨,该方法有哪些优点_________ (任写两条)。
 2NH3。请根据有关知识,填写下列空白:
2NH3。请根据有关知识,填写下列空白:(1)为了加快反应速率,可以采取的措施有
A.使用催化剂B.适当提高氮气的浓度C.适当提高反应的温度D.适当降低反应的温度
(2)从断键和成键的角度分析上述反应中能量的变化。根据下表数据,计算该反应生成1 mol NH3时放出
化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436 kJ | 946 kJ | 391 kJ |
 2NH3。
2NH3。
①其中,右室电极为燃料电池的
②相比现有工业合成氨,该方法有哪些优点
您最近半年使用:0次
名校
5 . I.(1)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
① CaSO4(s)+CO(g)=
CaSO4(s)+CO(g)= CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)= C(s)+
C(s)+ CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=___________________________________________________ (用ΔH1、ΔH2和ΔH3表示)。
(2)已知:25 ℃、101 kPa时,Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________ 。
(3)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
①2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
②NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
③(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
ΔH3和ΔH1、ΔH2之间的关系是ΔH3=__________________________________ 。
(4)已知: ①WO2(s)+2H2(g)=W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1
②WO2(g)+2H2(g)=W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1
则WO2(s)=WO2(g)的ΔH=_____________________________________________ 。
II.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测定混合液最高温度。回答下列问题:
(1)写出该反应的热化学方程式[生成1 mol H2O(l)时的反应热为-57.3 kJ/mol]:________________________________________________________________________ 。
(2)使盐酸与NaOH溶液混合均匀的正确操作是______ (填字母)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=________ (结果保留一位小数)。
①
 CaSO4(s)+CO(g)=
CaSO4(s)+CO(g)= CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)=
 C(s)+
C(s)+ CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1反应2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=
(2)已知:25 ℃、101 kPa时,Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是
(3)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
①2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
②NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
③(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
ΔH3和ΔH1、ΔH2之间的关系是ΔH3=
(4)已知: ①WO2(s)+2H2(g)=W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1
②WO2(g)+2H2(g)=W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1
则WO2(s)=WO2(g)的ΔH=
II.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测定混合液最高温度。回答下列问题:
(1)写出该反应的热化学方程式[生成1 mol H2O(l)时的反应热为-57.3 kJ/mol]:
(2)使盐酸与NaOH溶液混合均匀的正确操作是
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
您最近半年使用:0次
名校
解题方法
6 . 已知反应S2O (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )

①2Fe3+(aq)+2I-(aq) I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)
②2Fe2+(aq)+S2O (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)
 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
①2Fe3+(aq)+2I-(aq)
 I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O
 (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)| A.Fe3+是该反应的催化剂,加入Fe3+后降低了该反应的活化能 |
| B.反应①比反应②所需活化能大 |
| C.向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深 |
| D.该反应可设计成原电池 |
您最近半年使用:0次
2020-09-25更新
|
1721次组卷
|
14卷引用:山西省大同市2021届高三上学期学情调研测试化学试题
山西省大同市2021届高三上学期学情调研测试化学试题辽宁省六校协作体2021届高三第一次联考化学试题江西省赣州市会昌县七校2021届高三联合9月月考化学试题辽宁省开原市中固镇第二中学2021届高三上学期9月月考化学试题内蒙古自治区赤峰二中2020-2021学年高二上学期第一次月考化学试题江西省红色七校(分宜中学、会昌中学、莲花中学、南城一中、任弼时中学、瑞金一中、遂川中学)2021届高三上学期第一次联考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题江西省景德镇一中2020-2021学年高一下学期期中考试化学(1班)试题吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题江苏省苏州市姑苏区苏州中学2020-2021学年高二下学期期中考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题
解题方法
7 . 氮元素在海洋中的循环是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程如图所示,其中过程④的离子方程式为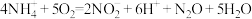 。下列说法正确的是
。下列说法正确的是

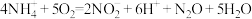 。下列说法正确的是
。下列说法正确的是
| A.①②③④均属于氮的固定 |
| B.海洋中的反硝化作用一定有氧气参加 |
| C.过程④中每生成1mol H2O共转移2mol e- |
D.向海洋中排放大量含 的废水会影响海洋中氮的循环 的废水会影响海洋中氮的循环 |
您最近半年使用:0次
2020-09-15更新
|
310次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第三章B 素养拓展区 过素养 学科素养拓展训练
名校
解题方法
8 . 2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵( )等。制备
)等。制备 的工艺流程如下:
的工艺流程如下:
饱和食盐水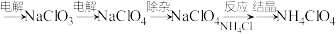 粗品
粗品
下列说法错误的是
 )等。制备
)等。制备 的工艺流程如下:
的工艺流程如下:饱和食盐水
 粗品
粗品下列说法错误的是
A. 属于离子化合物 属于离子化合物 |
B.该条件下溶解度: |
C.电解 溶解时阳极反应式为 溶解时阳极反应式为 |
D.该流程中可循环利用的物质是 |
您最近半年使用:0次
2020-09-07更新
|
406次组卷
|
7卷引用:吉林省东北师大附中2019-2020学年高三上学期第三次摸底考试化学试题
解题方法
9 . 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,发生反应:2SO2(g)+O2(g) 2SO3(g)。请回答下列问题:
2SO3(g)。请回答下列问题:
(1)反应过程的能量变化如图所示,则该反应为_______ (填“放热”或“吸热”)反应。

(2)恒温恒容时,下列措施能使该反应速率增大的是_______ (填字母)。
a.增加O2的浓度 b.选择高效催化剂 c.充入氦气 d.适当降低温度
(3)下列情况能够说明该反应达到化学平衡状态的是_______ (填字母)。
a. 2v正(O2)= v逆(SO2)
b.恒温恒容时,混合气体的密度不再随时间变化
c.SO3的物质的量不再变化
d.SO2、O2、SO3三者的浓度之比为2∶1∶2
(4)某次实验中,在容积为2 L的恒温密闭容器中通入10 mol SO2和a mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。
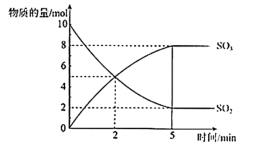
①2 min时,v正(SO2)_______ (填“>”、“<”或“=”) v逆(SO2)。
②用SO3的浓度变化表示0~5 min内反应的平均速率是_______ mol·L-1·min-1。
③反应达到平衡时,O2的体积分数为20%,则a=_______ mol。
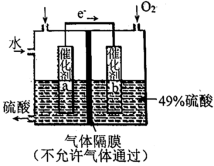
(5)下图是利用原电池原理,将SO2转化为重要的化工原料H2SO4的原理示意图,催化剂a表面发生反应的电极反应式为_________ 。
 2SO3(g)。请回答下列问题:
2SO3(g)。请回答下列问题:(1)反应过程的能量变化如图所示,则该反应为

(2)恒温恒容时,下列措施能使该反应速率增大的是
a.增加O2的浓度 b.选择高效催化剂 c.充入氦气 d.适当降低温度
(3)下列情况能够说明该反应达到化学平衡状态的是
a. 2v正(O2)= v逆(SO2)
b.恒温恒容时,混合气体的密度不再随时间变化
c.SO3的物质的量不再变化
d.SO2、O2、SO3三者的浓度之比为2∶1∶2
(4)某次实验中,在容积为2 L的恒温密闭容器中通入10 mol SO2和a mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。

①2 min时,v正(SO2)
②用SO3的浓度变化表示0~5 min内反应的平均速率是
③反应达到平衡时,O2的体积分数为20%,则a=
(5)下图是利用原电池原理,将SO2转化为重要的化工原料H2SO4的原理示意图,催化剂a表面发生反应的电极反应式为

您最近半年使用:0次
名校
解题方法
10 . 我国科学家研究出碳化钼负载金原子的催化体系,使CO和H2O在120℃下发生反应,其微观过程如图所示。下列说法正确的是( )
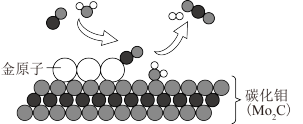

| A.图中仅有1种金属元素的原子 |
| B.反应前后分子种类、数目均不变 |
| C.金原子对CO起吸附催化作用 |
D.反应的化学方程式为:CO+H2O  H2+CO2 H2+CO2 |
您最近半年使用:0次



