名校
解题方法
1 . 碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:
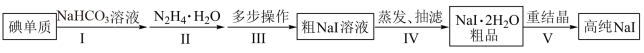
已知:
①I2(s)+I-(aq) I
I (aq)。
(aq)。
②水合肼(N2H4•H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO 离子。
离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为__ 。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是__ 。
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为__ 。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为__ 。
A.NaOH B.HI C.NH3•H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有__ 。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为__ 。
(5)将制备的NaI•2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序__ 。
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI•2H2O粗品溶解 ③趁热过滤 ④真空干燥
已知:
①I2(s)+I-(aq)
 I
I (aq)。
(aq)。②水合肼(N2H4•H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO
 离子。
离子。①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为
②实验过程中,加少量NaI固体能使反应速率加快,其原因是
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为
A.NaOH B.HI C.NH3•H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为
(5)将制备的NaI•2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI•2H2O粗品溶解 ③趁热过滤 ④真空干燥
您最近一年使用:0次
2020-07-10更新
|
307次组卷
|
4卷引用:内蒙古赤峰二中2019-2020学年高一下学期第二次月考(6月)化学试题
名校
解题方法
2 . 砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________ ,AsH3的电子式_________ 。
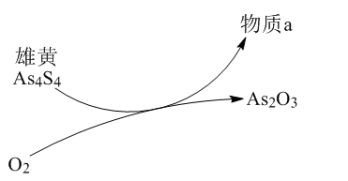
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________ (填化学式)。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) 2As(g) +3CO(g)
2As(g) +3CO(g) 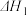 =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s)
 As4(g) +3CO(g)
As4(g) +3CO(g) 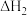 =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) 4As(g)
4As(g) 
① =
=_________ kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应: (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
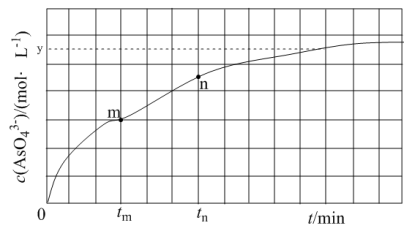
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v( )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c( )/c(
)/c( )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正( )
)_______ (填“大于”“小于”或“等于”)v逆(  )。
)。
③tm min时,v逆( )
) _______ (填“大于”“小于”或“等于”)tn时v逆(  ),理由是
),理由是___________________ 。
(1)As在元素周期表中的位置是
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s)
 2As(g) +3CO(g)
2As(g) +3CO(g)  =a kJ· mol-1
=a kJ· mol-1反应 II.As2O3(g) +3C(s)

 As4(g) +3CO(g)
As4(g) +3CO(g) 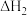 =b kJ ·mol-1
=b kJ ·mol-1反应III.As4(g)
 4As(g)
4As(g) 
①
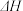 =
=②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
| 反应II | 反应III | ||
| 活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 | |
由表中数据判断催化剂X
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:
 (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可说明反应达到平衡的是
a.v(I- ) =2v(
 )
) b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(
 )/c(
)/c( )不再发生变化
)不再发生变化e.c(Na+) =5xmol· L-1
②tm min时,v正(
 )
) )。
)。③tm min时,v逆(
 )
)  ),理由是
),理由是
您最近一年使用:0次
名校
解题方法
3 . 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________ 。
(2)已知:
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的△H=
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____ 、_____ ,CO2的平衡转化率为______ 。
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为

①____________________________________ 。
②____________________________________ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
(2)已知:
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g)
 Si(s)+4HCl(g),该反应的△H=
Si(s)+4HCl(g),该反应的△H=(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为

①
②
您最近一年使用:0次
18-19高一下·内蒙古·期中
名校
解题方法
4 . (1)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_____ ,写出正极的电极反应式_________ 。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

①实验测得OH-定向移动向B电极,则___ 处电极入口通甲烷(填A或B),其电极反应式为____ 。
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___ 。
③电极反应的总反应方程式为_____ (填“吸热反应”或“放热反应”),下表中的数据表示破坏1mol化学键需要的能量,该反应的热量变化是____ kJ
(3)某可逆反应在某体积为5L的密闭容器中进行,在从0-3min各物质的量的变化情况如图所示(A,B,C均为气体)

①该反应的化学方程式为__________ 。
②反应开始至2min时,B的平均反应速率为_______ 。
③能说明该反应已达平衡状态的是_____
A.ν(A)=2ν(B)
B.容器内压强保持不变
C.2ν逆(A)=ν正(B)
D.容器内混合气体的密度保持不变
④在密闭容器内,通入amolA、bmolB、cmolC,发生上述反应,当改变下列条件时,反应速率会减小的是______
a.降低温度 b.加入催化剂 c.增大容器体积

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

①实验测得OH-定向移动向B电极,则
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
③电极反应的总反应方程式为
| 化学键 | C-H | O-O | O=O | C-O | C=O | H-O |
| 能量(kJ) | 415 | 138 | 498 | 343 | 798 | 465 |
(3)某可逆反应在某体积为5L的密闭容器中进行,在从0-3min各物质的量的变化情况如图所示(A,B,C均为气体)

①该反应的化学方程式为
②反应开始至2min时,B的平均反应速率为
③能说明该反应已达平衡状态的是
A.ν(A)=2ν(B)
B.容器内压强保持不变
C.2ν逆(A)=ν正(B)
D.容器内混合气体的密度保持不变
④在密闭容器内,通入amolA、bmolB、cmolC,发生上述反应,当改变下列条件时,反应速率会减小的是
a.降低温度 b.加入催化剂 c.增大容器体积
您最近一年使用:0次
名校
5 . 下列涉及化学学科观点的有关说法正确的是

| A.微粒观:二氧化硫是由硫原子和氧原子构成的 |
| B.转化观:升高温度可以将不饱和硝酸钾溶液转变为饱和 |
| C.守恒观:1g镁与1g稀硫酸充分反应后所得的溶液质量为2g |
| D.结构观:金刚石和石墨由于结构中碳原子的排列方式不同,物理性质存在着较大的差异 |
您最近一年使用:0次
2018-04-22更新
|
463次组卷
|
6卷引用:内蒙古通辽市开鲁县第一中学2020-2021学年高一上学期第一次月考化学试题
名校
6 . 已知2Fe2++Br2=2Fe3++2Br-。向200 mL的FeBr2溶液中通入标准状况下的Cl24.48 L,充分反应后测得溶液中Br-的物质的量是原溶液的一半,则原FeBr2溶液的物质的量浓度为
| A.2 mol/L | B.1 mol/L | C.0.4mol/L | D.0.2 mol/L |
您最近一年使用:0次
2018-04-13更新
|
502次组卷
|
2卷引用:内蒙古杭锦后旗奋斗中学2017-2018学年高一下学期第一次月考化学试题
11-12高一上·浙江杭州·期中
名校
7 . 等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L-1和b mol·L-1,则a与b的关系为
| A.2a=b | B.a=2b | C.a=b | D.a=5b |
您最近一年使用:0次
2017-10-31更新
|
476次组卷
|
12卷引用:内蒙古赤峰二中人教版高中化学必修1练习:化学计量及其应用(3)
内蒙古赤峰二中人教版高中化学必修1练习:化学计量及其应用(3)(已下线)2011-2012学年浙江省杭州高级中学高一上学期期中考试化学试卷2014-2015河南省周口中英文学校高一上学期12月月考化学试卷2016-2017学年黑龙江大庆铁人中学高一上期中化学卷河南省安阳县第一高级中学2017-2018学年高一上学期期中考试化学试题吉林省长春外国语学校2017-2018学年高一下学期期初考试化学试题山西省朔州市怀仁市第一中学2018-2019学年高一上学期期中考试化学试题(已下线)2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(已下线)2015届陕西省西安一中高三上学期第二次模考试化学试卷陕西省西安市第一中学2018届高三上学期第二次模拟考试化学试题夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——氮及其化合物(强化练习)(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)



