1 . 氢气是一种清洁能源,请根据实验室和工业上制氢及氢气性质回答相关问题。
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是______________ ;
(2)要加快上述实验中产生氢气的速率,还可采取的措施有______ 、_______ (列举两种措施)。
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因____________ 。
II.工业上海水制氢气的新技术:2H2O 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:
(1)分解海水的反应属于_____ 反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的____ 极。
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2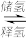 HCOONa+H2O。下列有关说法正确的是
HCOONa+H2O。下列有关说法正确的是____ 。
A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是
(2)要加快上述实验中产生氢气的速率,还可采取的措施有
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因
II.工业上海水制氢气的新技术:2H2O
 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:(1)分解海水的反应属于
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2
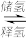 HCOONa+H2O。下列有关说法正确的是
HCOONa+H2O。下列有关说法正确的是A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
您最近一年使用:0次
名校
解题方法
2 . 一氧化碳甲烷化反应为:CO(g) + 3H2(g) = CH4(g) + H2O(g)。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。
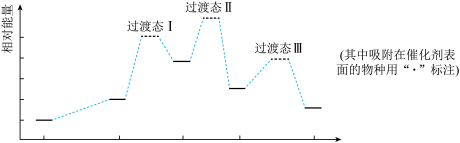
CO(g)+H2(g) CO(g)+·H
CO(g)+·H  ·CHO
·CHO  ·CH+H2O(g→CH4(g)
·CH+H2O(g→CH4(g)
下列说法不正确的是

CO(g)+H2(g)
 CO(g)+·H
CO(g)+·H  ·CHO
·CHO  ·CH+H2O(g→CH4(g)
·CH+H2O(g→CH4(g)下列说法不正确的是
| A.步骤①只有非极性键断裂 |
| B.步骤②的原子利用率为 100% |
| C.过渡态Ⅱ能量最高,因此其对应的步骤③反应速率最慢 |
| D.该方法可以清除剧毒气体CO,从而保护环境 |
您最近一年使用:0次
2020-07-01更新
|
449次组卷
|
3卷引用:山东省烟台第二中学2021-2022学年高一3月月月考化学试题
山东省烟台第二中学2021-2022学年高一3月月月考化学试题北京市海淀区北京大学附中2020 届高三化学阶段性测试化学试题(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编
名校
解题方法
3 . 以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。回答下列问题:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=3351kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是___ 。
(2)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。
如图是电解槽的示意图。

①写出电解时阳极的电极反应式:___ 。
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体。因此,需要不断补充石墨电极。工业生产中,每生产9吨铝阳极损失5.4吨石墨。每生产9吨铝转移电子的物质的量为___ mol,生成的二氧化碳的物质的量为___ mol。
(3)可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,以铝合金为负极。
①以NaCl溶液为电解质溶液时,正极反应式为___ 。
②以NaOH溶液为电解质溶液时,负极反应式为___ 。
(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=3351kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是
(2)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。
如图是电解槽的示意图。

①写出电解时阳极的电极反应式:
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体。因此,需要不断补充石墨电极。工业生产中,每生产9吨铝阳极损失5.4吨石墨。每生产9吨铝转移电子的物质的量为
(3)可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,以铝合金为负极。
①以NaCl溶液为电解质溶液时,正极反应式为
②以NaOH溶液为电解质溶液时,负极反应式为
您最近一年使用:0次
2020-05-13更新
|
124次组卷
|
2卷引用:山东省潍坊市五县市2019-2020学年高一下学期期中考试化学试题
名校
解题方法
4 . 硼氢化钠(NaBH4)在工业生产中应用广泛。它在催化剂作用下与水反应获取氢气的微观过程如图所示。下列说法正确的是( )
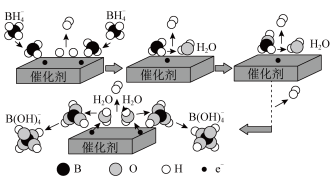

| A.水在此过程中作还原剂 |
| B.若将NaBH4中的H用D代替,反应后生成的气体中含有H2、HD和D2 |
| C.催化剂可以加快反应速率,其用量多少不影响反应速率 |
| D.NaBH4与水反应的离子方程式为:BH4-+4H2O=B(OH)4-+4H2↑ |
您最近一年使用:0次
2020-04-05更新
|
631次组卷
|
3卷引用:山东省枣庄三中、高密一中、莱西一中2020届高三下学期第一次在线联考化学试题
名校
5 . 我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
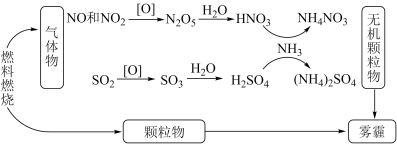
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有________ (写化学式)。
(2)图中物质溶于水溶液呈碱性的是________ 。
(3)写出SO2转化为SO3的化学方程式________________________ 。
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为________________ 。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________ (用化学方程式表示)。
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为________________ 。

回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有
(2)图中物质溶于水溶液呈碱性的是
(3)写出SO2转化为SO3的化学方程式
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为
您最近一年使用:0次
2020-01-17更新
|
644次组卷
|
8卷引用:山东省潍坊市2019-2020学年高一上学期期末考试化学试题
6 . 氨氮废水超标排放是水体富营养化的重要原因,可用以下流程处理:

下列说法正确的是

下列说法正确的是
| A.过程I中发生的化学反应属于氧化还原反应 |
B.过程Ⅱ中 ,每转化 ,每转化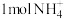 转移的电子数为6NA 转移的电子数为6NA |
| C.过程Ⅲ中CH3OH→CO2,甲醇作还原剂 |
| D.过程Ⅲ中HNO3→N2,转移10mol e-时可生成N2 11.2L(标准状况) |
您最近一年使用:0次
2020-01-17更新
|
337次组卷
|
5卷引用:山东省潍坊市2019-2020学年高一上学期期末考试化学试题
山东省潍坊市2019-2020学年高一上学期期末考试化学试题江苏省淮安市金湖、洪泽等六校2020-2021学年高一下学期联考期中考试(第六次学情调查)化学试题江苏省盐城市华东师范大学盐城实验中学2020-2021学年高一下学期第二次质量监测化学试题河南省南阳市第一中学校2021-2022学年高一上学期第六次月考化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(11-20)
名校
7 . 已知X和Y能发生如下反应:X+Y=H2O+盐,下列有关物质X和Y所属种类的判断中一定不正确的是( )
| A.X为酸、Y为碱 | B.X为碱性氧化物、Y为酸 |
| C.X为盐、Y为碱 | D.X为碱性氧化物、Y为酸性氧化物 |
您最近一年使用:0次
2018-09-12更新
|
1834次组卷
|
31卷引用:【全国百强校】山东省枣庄市第八中学东校区2019届高三9月月考化学试题
【全国百强校】山东省枣庄市第八中学东校区2019届高三9月月考化学试题贵州省毕节市织金县第一中学2018-2019学年高一上学期12月份考试化学试题鲁科版新教材(2019)化学同步2.1.1 元素与物质的关系 物质分类与物质性质福建省莆田市第六中学2019-2020学年高一上学期第一次月考化学试题(B)云南省福贡县第一中学2019-2020学年高一上学期期末考试化学试题人教版高一化学必修1第二章《化学物质及其变化》测试卷(已下线)专题2.1 物质的分类 胶体 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)2.1.1 元素与物质的关系 物质分类与物质性质练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)专题01 物质的分类及转化(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学广东省深圳市第七高级中学2020-2021学年高一上学期第一学段考试化学试题(已下线)练习2 物质的转化-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)山东省“学情空间”区域教研共同体2022-2023学年高一上学期10月联考(人教版)化学试题云南省峨山彝族自治县峨山一中2018-2019学年高二入学考试化学试题备战2020高考化学二轮专项训练:多角度考查物质变化(已下线)衔接点02 酸碱盐的分类和命名-2021年初升高化学无忧衔接(已下线)衔接点03 酸碱盐的分类和命名-2022年初升高化学无忧衔接广东省揭阳华侨高级中学2021-2022学年高一上学期第一次阶段考试化学试题黑龙江省哈尔滨市第一中学2021-2022学年高一上学期期中考试化学试题 甘肃省兰州市西固区三校2021-2022学年高一上学期期中联考化学试题广西钦州市第四中学2021-2022学年高一上学期期中考试化学试题吉林省长春外国语学校2022-2023学年高一上学期第一次月考化学试题甘肃省天水市第一中学2022-2023学年高一上学期第一学段检测化学试题第2课时 物质的转化甘肃省部分学校2023-2024学年高一上学期10月期中考试化学试题湖北省荆州市沙市中学2023-2024学年高一上学期9月月考化学试题河北省石家庄北华中学2023-2024学年高一上学期10月月考考试化学试题(已下线)课时03 物质的组成、分类和性质-2022年高考化学一轮复习小题多维练(全国通用)福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期中考试化学试题(已下线)第01练 物质的分类及转化-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第二章 化学物质及其变化 第1讲 物质的变化及分类
8 . 下列说法中不正确的是
| A.离子化合物中可能有非金属元素 |
| B.共价化合物中一定不含有离子键,离子化合物中可能存在共价键 |
| C.吸热反应不一定需要加热就能发生 |
| D.一定条件下lmolN2与3molH2在密闭容器中充分反应可生成2molNH3 |
您最近一年使用:0次
名校
9 . 肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________ 。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________ 。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。
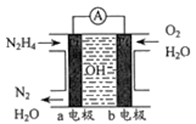
①该电池的负极是______ (填“a”或“b”)电极。
②写出正极的电极反应式:_____________ 。
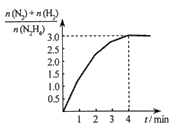
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中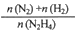 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______ 。

(1)已知肼的球棍模型如图所示,写出肼的电子式:
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是
②写出正极的电极反应式:
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l)
 N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中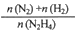 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
您最近一年使用:0次
2018-07-04更新
|
367次组卷
|
3卷引用:【全国百强校】江苏省常熟中学2017-2018学年高一下学期期末调研测试化学试题
10 . (1)22克CO2的物质的量为_________ mol,其中含有O原子的个数为_____________ ,含质子的物质的量为____ mol,该气体在标准状况下的体积为_________ L。
(2)写出下列反应的离子方程式。Fe2O3与稀盐酸反应_________________________________
(3)写出下列离子方程式对应的任意一个化学方程式。2H++CO32- CO2↑+H2O
CO2↑+H2O __________________________________ ;
(2)写出下列反应的离子方程式。Fe2O3与稀盐酸反应
(3)写出下列离子方程式对应的任意一个化学方程式。2H++CO32-
 CO2↑+H2O
CO2↑+H2O
您最近一年使用:0次



