1 . 铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
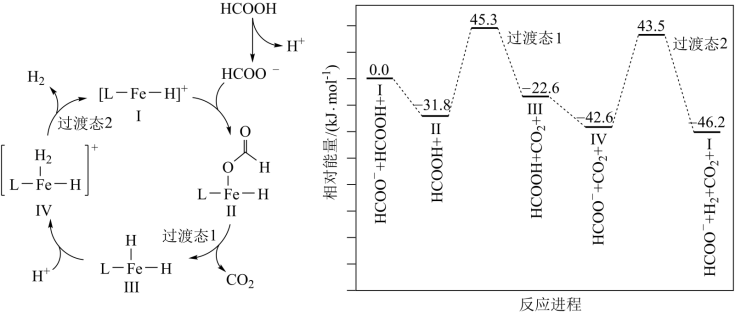
下列说法错误的是
 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是
A.该过程的总反应为 |
B. 浓度过大或者过小,均导致反应速率降低 浓度过大或者过小,均导致反应速率降低 |
C.该催化循环中 元素的化合价发生了变化 元素的化合价发生了变化 |
| D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定 |
您最近一年使用:0次
2021-06-09更新
|
9200次组卷
|
39卷引用:2020年山东卷化学高考真题变式题11-15
(已下线)2020年山东卷化学高考真题变式题11-152021年新高考湖南化学高考真题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)江苏省如皋中学2021-2022学年高三上学期期初测试化学试题(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)安徽省合肥工业大学附属中学2021-2022学年高三上学期第一次阶段考试化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)2021年湖南省高考化学试卷变式题11-19(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题10 化学反应与能量-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷10 化学反应机理选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题09 化学反应速率、化学平衡-三年(2020-2022)高考真题分项汇编(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第15讲 化学反应的热效应 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题36 高考“明星”考点—催化剂-备战2023年高考化学一轮复习考点微专题(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题湖南省衡阳师范学院祁东附属中学2021-2022学年高三上学期12月月考化学试题(已下线)专题12 化学反应机理(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)素养卷02 循环转化过渡态理论图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)热点题型训练 催化剂与反应历程(机理)(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山东省泰安市部分学校2023-2024学年高二上学期期末调研化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题山东省威海市乳山市银滩高级中学2023-2024学年高二上学期1月模块考试化学试题辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题北京市第八中学2021-2022学年高二上学期期中考试化学试题江苏省海安高级中学2021-2022学年高二上学期阶段测试(二)化学试题北京大学附属中学2021-2022学年高二下学期期末考试化学试卷
名校
解题方法
2 . 氮及其化合物的转化过程如图所示。下列分析合理的是
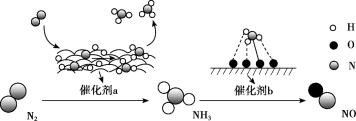

| A.催化剂a表面只发生极性共价键的断裂和形成 |
| B.N2与H2反应生成NH3的原子利用率为100% |
| C.在催化剂b表面形成氮氧键时,不涉及电子转移 |
| D.催化剂a、b能提高反应的平衡转化率 |
您最近一年使用:0次
2021-05-19更新
|
787次组卷
|
23卷引用:山东省2020届高三模拟考试化学试题
山东省2020届高三模拟考试化学试题山东省潍坊市昌乐县2020年高三上学期第一次高考模拟化学试题山东省2020届普通高中学业水平等级考试 · 模拟卷(三)化学试题【区级联考】北京市朝阳区2019届高三下学期二模考试化学试题云南省玉溪一中2020届高三上学期期中考试理综化学试题辽宁省沈阳市五校协作体2020届高三上学期期中考试化学试题北京市石景山区精华学校2019-2020学年高三上学期二次月考化学试题北京市房山区2020届高三一模化学试题天津市南开区2020届高三上学期期末考试化学试题福建省福州市2019届高三5月高考模拟化学试题新疆吾尔自治区乌鲁木齐市第七十中学2021届高三上学期第一次月考(9月)化学试题安徽省涡阳县第一中学2021届高三上学期第二次月考化学试题河北省枣强中学2019-2020学年高二下学期第三次月考化学试题天津市西青区张家窝中学2022届高三上学期第一次月考化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-测试(已下线)2022年江苏卷高考真题变式题1-13(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题6-10)北京市中国人民大学附属中学朝阳学校2021-2022学年高三上学期第一次月考化学试题(已下线)物质反应及转化湖南省张家界市2020-2021学年高二上学期期末考试化学试题福建省莆田第一中学2020-2021学年高二下学期期中考试化学试题湖南省长沙市宁乡市2020-2021学年高二下学期期末调研考试化学试题陕西省榆林市2023-2024学年高二上学期10月月考化学试题
20-21高三上·广东·阶段练习
解题方法
3 . 低碳转化是当今世界重要科研课题之一,科学家们提出了多种途径来实现低碳转化。
(1)CO2可以转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=−184 kJ·mol−1。该转化过程正反应的活化能为a kJ·mol−1,则逆反应的活化能为
CH3OH(g)+H2O(g) ΔH=−184 kJ·mol−1。该转化过程正反应的活化能为a kJ·mol−1,则逆反应的活化能为_______ kJ·mol−1(用含a的式子表示);与该反应有关的化学键的键能数据如下表,则表中x=_______ 。
(2)CO2与H2在一定条件下还能转化为CH4,同时发生副反应产生CO,有关图象如下。CO2与H2转化为CH4适宜的条件为_______ 。

(3)中科院上海高等研究院将CO2在Na−Fe3O4/HZSM−5催化下转变为汽油(C5~C11的烃),辛烷值最高含量可达78%左右,该研究成果在《Nature Chemistry》上发表,并已申报中国发明专利和国际PCT专利。反应过程如下图所示。

①若CO2在该条件下转化为辛烷,请写出该反应的化学方程式_______ 。
②催化剂中的Fe3O4可用铁做电极,稀硫酸为电解质,然后通过电解来制备,写出电解时的阳极反应式:_______ 。
③下列关于该转化方法的说法合理的是_______ (填标号)。
a.Na−Fe3O4/HZSM−5不参与反应过程,可以降低反应的活化能
b.CO2在该条件下转化为戊烷或辛烷,均需三步反应
c.反应过程中有非极性键的断裂,没有非极性键的生成
d.该方法有助于减少CO2排放,同时减轻对化石燃料的依赖
(1)CO2可以转化为甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=−184 kJ·mol−1。该转化过程正反应的活化能为a kJ·mol−1,则逆反应的活化能为
CH3OH(g)+H2O(g) ΔH=−184 kJ·mol−1。该转化过程正反应的活化能为a kJ·mol−1,则逆反应的活化能为| 化学键 | C=O | C–O | C–H | H–H | O–H |
| 键能/kJ·mol−1 | x | 351 | 415 | 436 | 462 |

(3)中科院上海高等研究院将CO2在Na−Fe3O4/HZSM−5催化下转变为汽油(C5~C11的烃),辛烷值最高含量可达78%左右,该研究成果在《Nature Chemistry》上发表,并已申报中国发明专利和国际PCT专利。反应过程如下图所示。

①若CO2在该条件下转化为辛烷,请写出该反应的化学方程式
②催化剂中的Fe3O4可用铁做电极,稀硫酸为电解质,然后通过电解来制备,写出电解时的阳极反应式:
③下列关于该转化方法的说法合理的是
a.Na−Fe3O4/HZSM−5不参与反应过程,可以降低反应的活化能
b.CO2在该条件下转化为戊烷或辛烷,均需三步反应
c.反应过程中有非极性键的断裂,没有非极性键的生成
d.该方法有助于减少CO2排放,同时减轻对化石燃料的依赖
您最近一年使用:0次
20-21高三上·广东·阶段练习
4 . 据报道,亚硝胺[(CH3)2N−N=O]是一种直接的致癌物质,亚硝酸与二甲胺[(CH3)2NH]相遇会迅速反应生成亚硝胺,其反应机理如下图所示:

下列说法正确的是

下列说法正确的是
| A.亚硝酸与二甲胺生成亚硝胺的反应是吸热反应 |
| B.过程i发生的是加成反应,过程ii发生的是取代反应 |
| C.过程i的反应速率比过程ii的反应速率慢 |
| D.降低温度在一定程度上会抑制亚硝胺的生成 |
您最近一年使用:0次
解题方法
5 . 乙烯是现代工业的重要原材料,研究工业制取乙烯有重要的意义。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1
Ⅱ.C2H6(g)+2CO2(g) 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1
反应的能量变化图如图所示:
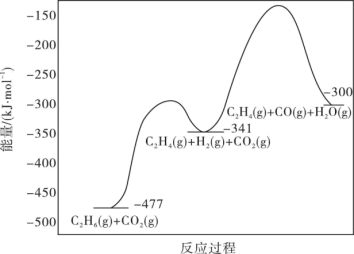
①C2H6(g)+2CO(g)+3H2(g) 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=____ kJ·mol-1
②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是___ ;一定温度和压强下,为了提高反应速率和乙烯的选择性,应当___ 。
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g) C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
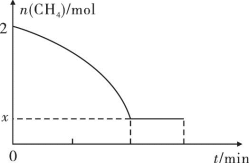
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为____ ;若将温度升高,速率常数增大的倍数:k正___ k逆(填“>”“=”或“<”)。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)
 C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1Ⅱ.C2H6(g)+2CO2(g)
 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1反应的能量变化图如图所示:

①C2H6(g)+2CO(g)+3H2(g)
 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)
 C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为
您最近一年使用:0次
2020-12-26更新
|
1505次组卷
|
3卷引用:北京市昌平区新学道临川学校2021届高三12月月考化学试题
6 . CO在工农业生产及科学研究中有着重要应用。
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化制作用下发生反应:2NO2(g)+4CO(g)⇌N2(g)+4CO2(g)△H=-127.8kJ/mol,测得相关数据如下:
①其他条件不变,若不使用催化剂,则0~5min内NO2的转化率将___ 。(填“变大”、“变小”或“不变”)
②下列表述能说明该反应已达到平衡状态的是___ 。(填序号)
A.CO的化学反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是___ 。(填序号)
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂Ni的羰化反应为:Ni(s)+4CO(g)⇌Ni(CO)4(g)△H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的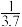 。则:
。则:
①0~10min内平均反应速率v(Ni)=___ g/min。
②研究表明,正反应速率v正=k正•x4(CO),逆反应速率v逆=k逆•x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的 =
=___ 。
(3)CH4与CO2经催化反应可制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH
已知:反应1:CH4(g)=C(s)+2H2(g)ΔH1=+75kJ/mol
反应2:2CO(g)=C(s)+CO2(g)ΔH2=-172kJ/mol则该催化反应的ΔH=___ kJ/mol。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子H将碱性溶液中的NO 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
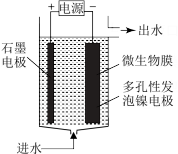
①写出活性原子与NO 反应的离子方程式
反应的离子方程式___ 。
②若阳极生成标准状况下2.24L气体,理论上可除去NO 的物质的量为
的物质的量为___ mol。
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化制作用下发生反应:2NO2(g)+4CO(g)⇌N2(g)+4CO2(g)△H=-127.8kJ/mol,测得相关数据如下:
| 时间 浓度 | 0min | 5min | 10min | 15min | 20min |
| c(NO2)/mol/L | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol/L | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②下列表述能说明该反应已达到平衡状态的是
A.CO的化学反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂Ni的羰化反应为:Ni(s)+4CO(g)⇌Ni(CO)4(g)△H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
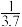 。则:
。则:①0~10min内平均反应速率v(Ni)=
②研究表明,正反应速率v正=k正•x4(CO),逆反应速率v逆=k逆•x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的
 =
=(3)CH4与CO2经催化反应可制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH
已知:反应1:CH4(g)=C(s)+2H2(g)ΔH1=+75kJ/mol
反应2:2CO(g)=C(s)+CO2(g)ΔH2=-172kJ/mol则该催化反应的ΔH=
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子H将碱性溶液中的NO
 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
①写出活性原子与NO
 反应的离子方程式
反应的离子方程式②若阳极生成标准状况下2.24L气体,理论上可除去NO
 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
7 . 研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法的不正确的是
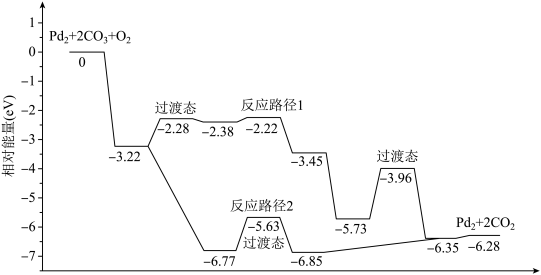

| A.该过程中有极性键和非极性键的断裂和生成 |
| B.反应路径2的催化效果更好 |
| C.催化剂不会改变整个反应的ΔH |
| D.路径1中最大能垒(活化能)E正=1.23eV |
您最近一年使用:0次
2020-12-08更新
|
1113次组卷
|
7卷引用:湖北省武汉市东西湖区华中师范大学第一附属中学2021届高三上学期期中考试化学试题
解题方法
8 . 聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:
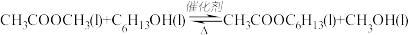
已知v正=k正χ(CH3COOCH3)·χ(C6H13OH),v逆=k逆χ(CH3COOC6H13)·χ(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,χ为备组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的
_______ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数KX=________ (保留2位有效数字)。
在曲线①、②、③中,k正—k逆值最小的曲线是______________ ;A、B、C、D四点中,v正最小的是_____________ ,v逆最大的是_________________ 。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到甲衡后,初始投料比__________ 时,乙酸甲酯转化率最大;与按2:1投料相比,按1:2投料时化学平衡常数KX_____________ (填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法不正确的是_______
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
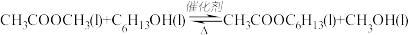
已知v正=k正χ(CH3COOCH3)·χ(C6H13OH),v逆=k逆χ(CH3COOC6H13)·χ(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,χ为备组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的

在曲线①、②、③中,k正—k逆值最小的曲线是
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到甲衡后,初始投料比
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法不正确的是
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
您最近一年使用:0次
9 . 下列图示与对应的叙述不相符的是( )
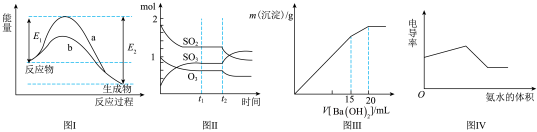

| A.图Ⅰ表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化 |
B.图Ⅱ表示一定条件下进行的反应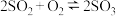 各成分的物质的量变化, 各成分的物质的量变化, 时刻改变的条件可能是缩小容器体积 时刻改变的条件可能是缩小容器体积 |
C.图Ⅲ表示某明矾溶液中加入 溶液,沉淀的质量与加入 溶液,沉淀的质量与加入 溶液体积的关系,在加入 溶液体积的关系,在加入 溶液时铝离子恰好沉淀完全 溶液时铝离子恰好沉淀完全 |
| D.电导率可表示溶液导电性的强弱,电导率越大导电性越强,图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系 |
您最近一年使用:0次
解题方法
10 . 以废旧磷酸亚铁锂电池正极片( 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。

回答下列问题:
(1) 中Fe元素的化合价为
中Fe元素的化合价为_________ ;“放电处理”有利于锂在正极的回收,其原因是__________ 。
(2)“碱浸”中发生反应的离子方程式为________________________________ 。
(3)“浸取”中加入 的作用为
的作用为________________ ;“沉铁”过程所得滤渣为白色固体,其主要成分是________________ 。
(4)已知碳酸锂的分解温度为 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是________________ ; 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为_____ 。
(5)写出“焙烧”过程中生成锰酸锂的化学方程式_________________________________ 。
 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。
回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“碱浸”中发生反应的离子方程式为
(3)“浸取”中加入
 的作用为
的作用为(4)已知碳酸锂的分解温度为
 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为(5)写出“焙烧”过程中生成锰酸锂的化学方程式
您最近一年使用:0次
2020-11-24更新
|
567次组卷
|
2卷引用:山东省临沂市2021届高三上学期期中考试化学试题



