名校
1 . 某研究小组探究催化剂对CO、NO转化的影响。将含NO和CO的尾气以一定的流速通过两种不同的催化剂进行反应:2NO(g)+2CO(g)  N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
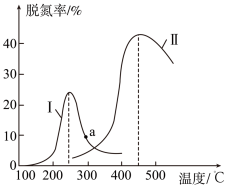
①两种催化剂均能降低活化能,但ΔH不变
②相同条件下,改变压强对脱氮率没有影响
③曲线Ⅱ中的催化剂适用于450 ℃左右脱氮
④曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
⑤ a 点是对应温度下的平衡脱氮率
⑥若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因是催化剂的活性不高
 N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
①两种催化剂均能降低活化能,但ΔH不变
②相同条件下,改变压强对脱氮率没有影响
③曲线Ⅱ中的催化剂适用于450 ℃左右脱氮
④曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
⑤ a 点是对应温度下的平衡脱氮率
⑥若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因是催化剂的活性不高
| A.①③⑥ | B.①③④ | C.②③④ | D.①③⑤ |
您最近一年使用:0次
解题方法
2 . 用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2molCO2和6molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),请回答下列问题:
CH3OH(g)+H2O(g),请回答下列问题:
(1)能判断该反应已达化学平衡状态的标志是___ (填字母)。
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的密度保持不变
D.CO2的生成速率与CH3OH的生成速率相等
(2)现测得CO2和CH3OH(g)的浓度随时间变化如图所示,回答下列问题:
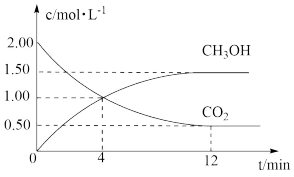
①从反应开始到平衡,氢气的平均反应速率v(H2)=___ 。
②平衡时甲醇的体积分数为___ ;CO2的转化率为___ 。
(3)以KOH为电解质溶液的甲醇燃料电池的总反应为2CH3OH+3O2+4KOH=2KCO3+6H2O。通入氧气的电极为燃料电池的___ (填“正”或“负”)极,负极发生的电极反应式为___ 。
 CH3OH(g)+H2O(g),请回答下列问题:
CH3OH(g)+H2O(g),请回答下列问题:(1)能判断该反应已达化学平衡状态的标志是
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的密度保持不变
D.CO2的生成速率与CH3OH的生成速率相等
(2)现测得CO2和CH3OH(g)的浓度随时间变化如图所示,回答下列问题:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②平衡时甲醇的体积分数为
(3)以KOH为电解质溶液的甲醇燃料电池的总反应为2CH3OH+3O2+4KOH=2KCO3+6H2O。通入氧气的电极为燃料电池的
您最近一年使用:0次
名校
解题方法
3 . 甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:
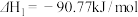
反应②:
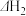
反应③:
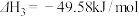
(1)若500℃时三个反应的平衡常数依次为K1、K2、K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时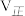
__________ 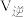 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
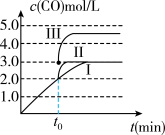
(2)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线Ⅰ所示。若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线III。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____________ 。当通过改变压强使曲线Ⅰ变为曲线III时,曲线III达到平衡时容器的体积为___________ 。
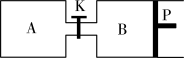
(3)在另一温度下按反应③合成甲醇的反应,如图关闭K,向A容器中充入1molCO2和4molH2,向B容器中充入1.2molCO2和4.8molH2,两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为0.9aL,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为__________ L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。
反应①:

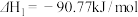
反应②:

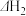
反应③:

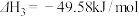
(1)若500℃时三个反应的平衡常数依次为K1、K2、K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时
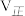
 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)(2)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线Ⅰ所示。若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线III。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是

(3)在另一温度下按反应③合成甲醇的反应,如图关闭K,向A容器中充入1molCO2和4molH2,向B容器中充入1.2molCO2和4.8molH2,两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为0.9aL,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为

您最近一年使用:0次
4 . (1) ①已知2H2(g)+O2(g)=2H2O(g);ΔH1 = -483.6kJ·mol-1,②2H2(g)+O2(g)=2H2O(l);ΔH1 = -571.6kJ·mol-1,则氢气的热值为_____ ;
(2) CaC2是离子化合物,各原子均满足8电子稳定结构,其电子式为______ ;
(3) 在常压下,HF的沸点比HCl的沸点高。主要原因是________ 。
(4) 已知有关反应及不同温度下的平衡常数如下表:
①反应Ⅲ自发进行的条件___ (填“高温”、“低温”或“任意温度”);②500℃时,测得反应Ⅲ在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol· L−1)分别为0.8、0.1、0.3、0.15,则此时反应速率v正___ v逆(“>”、“=”或“<”)。
(5) 铅蓄电池放电时的正极反应式______
(2) CaC2是离子化合物,各原子均满足8电子稳定结构,其电子式为
(3) 在常压下,HF的沸点比HCl的沸点高。主要原因是
(4) 已知有关反应及不同温度下的平衡常数如下表:
| 化学反应 | 平衡常数 | 500℃ | 800℃ |
Ⅰ.2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
Ⅱ.H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.5 |
Ⅲ.3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 |
①反应Ⅲ自发进行的条件
(5) 铅蓄电池放电时的正极反应式
您最近一年使用:0次
5 . 为了防止氮氧化物对空气的污染,人们采取了很多措施。
(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
①下列有关说法正确的是_________ 。
A. 在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B. 恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C. 体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D. 恒温恒压时,充入氩气有利于提高氮氧化物的转化率
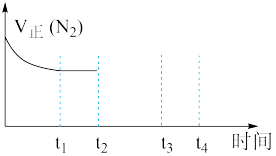
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在如图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:____________
(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g) N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________ 。
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=_______________ 。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如P(NO2)为NO2的平衡分压,P(NO2)=x(NO2)P, P为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为_____________ 。

(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。①下列有关说法正确的是
A. 在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B. 恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C. 体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D. 恒温恒压时,充入氩气有利于提高氮氧化物的转化率
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在如图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:

(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g)
 N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染| 反应 | 25℃时的平衡常数 | 焓变 |
反应I:2NO(g) N2(g)+O2(g) N2(g)+O2(g) | K1=1×1030 | ΔH=-180.5kJ/mol |
反应II:2CO2 (g) 2CO(g)+O2(g) 2CO(g)+O2(g) | K2=4×10-92 | ΔH= +566.0kJ/mol |
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g)
 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为

您最近一年使用:0次
名校
解题方法
6 . 汽车尾气包括CO、碳氢化合物、NOx(氮氧化合物)等,三元催化器中净化原理如图所示。下列说法正确的是
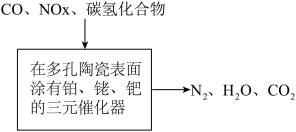

| A.铂、铑、钯属于主族元素 |
| B.三元催化器中的催化剂可降低该反应的活化能 |
| C.三元催化器中的多孔陶瓷可提高平衡时反应物的转化率 |
| D.在反应NO+CO→N2+CO2中,每生成1molN2时转移2mol电子 |
您最近一年使用:0次
2020-08-17更新
|
387次组卷
|
4卷引用:云南省昆明市2019-2020学年高二下学期期末质量检测化学试题
云南省昆明市2019-2020学年高二下学期期末质量检测化学试题(已下线)《新教材变化解读及考法剖析 》—化学(人教版2019必修第一册)第一章河北省张家口市第一中学2020-2021学年高二上学期10月月考(衔接班)化学 试题云南省昆明市四川师范大学附属昆明实验学校(安宁校区)2020-2021学年高一上学期期末考试化学试题
解题方法
7 . 硫在自然界的循环过程如图所示,下列说法错误的是


| A.氢、氧两种元素也参与了硫的循环 |
| B.在生成硫酸的过程中,SO2发生还原反应 |
| C.工厂产生的含SO2的烟气应经脱硫处理以减少环境污染 |
| D.火山气体中的H2S和SO2可以发生如下反应:2H2S+SO2=3S+2H2O,氧化产物与还原产物的物质的量之比为2:1 |
您最近一年使用:0次
2020-08-17更新
|
207次组卷
|
2卷引用:云南省昆明市2019-2020学年高二下学期期末质量检测化学试题
名校
解题方法
8 . 1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯(CH2=CHCH3)加成法生产(反应i),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
i.CH2=CHCH3(g)+Cl2(g) CH2ClCHClCH3(g) △H1=-134kJ/mol
CH2ClCHClCH3(g) △H1=-134kJ/mol
ii.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) △H2=-102kJ/mol。
CH2=CHCH2Cl(g)+HCl(g) △H2=-102kJ/mol。
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g) CH2ClCHClCH3(g)的活化能Ea(正)为132 k/mol,则该反应的活化能Ea(逆)为
CH2ClCHClCH3(g)的活化能Ea(正)为132 k/mol,则该反应的活化能Ea(逆)为________ kJ/mol。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHClCH3的产率______ (填“增大“减小”或“不变”),理由是__________ 。
(3)T℃时,向10 L恒容的密闭容器中充入1molCH2=CHCH2Cl和2molHCl,只发生反应CH2=CHCH2Cl(g)+HCl(g) CH2ClCHClCH3(g) △H3,5 min反应达到平衡,测得0~5min内,用CH2ClCHClCH3表示的反应速率v(CH2ClCHClCH3)=0.016mol/(L·min)。
CH2ClCHClCH3(g) △H3,5 min反应达到平衡,测得0~5min内,用CH2ClCHClCH3表示的反应速率v(CH2ClCHClCH3)=0.016mol/(L·min)。
①平衡时,HCl的体积分数为_________ (保留三位有效数字)。
②保持其它条件不变,6min时再向该容器中充入0.6 molCH2=CHCH2Cl、0.2 mol HCl和0.1 molCH2ClCHClCH3,则起始反应速率v 正(HCl)_________ (填“>”“<”或“=”)v逆(HCl)。
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和Cl2发生反应ii。设起始的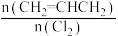 =w,平衡时Cl2的体积分数(
=w,平衡时Cl2的体积分数( )与温度(T)、w的关系如图甲所示。w=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
)与温度(T)、w的关系如图甲所示。w=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
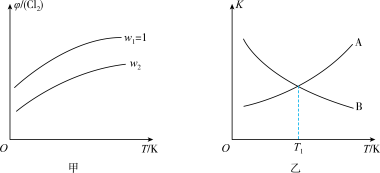
①图甲中,w2________ (填“>”“<”或“=”)1。
②图乙中,表示正反应平衡常数的曲线为___ (填“A”或"B")。
(5)起始时向某恒容绝热容器中充入1molCH2=CHCH3和1molCl2发生反应ii,达到平衡时,容器内气体压强与起始时相比________ (填“增大“减小”或“不变”)。
i.CH2=CHCH3(g)+Cl2(g)
 CH2ClCHClCH3(g) △H1=-134kJ/mol
CH2ClCHClCH3(g) △H1=-134kJ/molii.CH2=CHCH3(g)+Cl2(g)
 CH2=CHCH2Cl(g)+HCl(g) △H2=-102kJ/mol。
CH2=CHCH2Cl(g)+HCl(g) △H2=-102kJ/mol。请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)
 CH2ClCHClCH3(g)的活化能Ea(正)为132 k/mol,则该反应的活化能Ea(逆)为
CH2ClCHClCH3(g)的活化能Ea(正)为132 k/mol,则该反应的活化能Ea(逆)为(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHClCH3的产率
(3)T℃时,向10 L恒容的密闭容器中充入1molCH2=CHCH2Cl和2molHCl,只发生反应CH2=CHCH2Cl(g)+HCl(g)
 CH2ClCHClCH3(g) △H3,5 min反应达到平衡,测得0~5min内,用CH2ClCHClCH3表示的反应速率v(CH2ClCHClCH3)=0.016mol/(L·min)。
CH2ClCHClCH3(g) △H3,5 min反应达到平衡,测得0~5min内,用CH2ClCHClCH3表示的反应速率v(CH2ClCHClCH3)=0.016mol/(L·min)。①平衡时,HCl的体积分数为
②保持其它条件不变,6min时再向该容器中充入0.6 molCH2=CHCH2Cl、0.2 mol HCl和0.1 molCH2ClCHClCH3,则起始反应速率v 正(HCl)
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和Cl2发生反应ii。设起始的
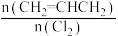 =w,平衡时Cl2的体积分数(
=w,平衡时Cl2的体积分数( )与温度(T)、w的关系如图甲所示。w=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
)与温度(T)、w的关系如图甲所示。w=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
①图甲中,w2
②图乙中,表示正反应平衡常数的曲线为
(5)起始时向某恒容绝热容器中充入1molCH2=CHCH3和1molCl2发生反应ii,达到平衡时,容器内气体压强与起始时相比
您最近一年使用:0次
9 . 一氧化碳可用于制甲酸钠,也可以在冶金工业中作还原剂,还可以作气体燃料,如水煤气(一氧化碳和氢气等气体的混合物)。在恒温恒容密闭容器中发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)。请回答下列问题:
(1)加快该反应速率的措施是_______________ (写一条即可)。
(2)已知化学键的键能(E)数据如下表:
由此计算生成1 mol CO2_________ (吸收或放出)能量______ kJ。
(3)判断该反应达到平衡的依据是______ 。
A.正、逆反应速率都为零
B.容器内压强不再变化
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.单位时间内生成1 mol H2,同时生成1 mol CO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:

①反应到4 min时,H2O(g)的转化率=_____ 。
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率v(CO)=_______ ;反应达平衡时,H2的体积分数=________ 。
(1)加快该反应速率的措施是
(2)已知化学键的键能(E)数据如下表:
| 化学键 | H-H | C=O | C≡O( CO) | H-O |
| E/(kJ/mol) | 436 | 750 | 1076 | 463 |
(3)判断该反应达到平衡的依据是
A.正、逆反应速率都为零
B.容器内压强不再变化
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.单位时间内生成1 mol H2,同时生成1 mol CO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:

①反应到4 min时,H2O(g)的转化率=
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率v(CO)=
您最近一年使用:0次
名校
解题方法
10 . CH4既是一种重要的能源,也是一种重要的化工原料。
(1)以CH4和空气为原料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,通入b气体的电极反应式为____ 。

(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在____ 左右。

②已知在101kPa、25℃时,32g CH4与CO2完全反应生成乙酸,放出26.6kJ热量,其热化学方程式为____ 。
(3)CH4在高温下可与水蒸气发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g),在体积2L的密闭容器中冲入一定量CH4和水蒸气,反应中测得CH4和CO物质的量随时间变化如图所示:

①从3 min到12 min,v(H2)=______ 。
②能说明上述反应达到化学平衡状态的是____ 。
A.CH4的体积分数保持不变
B.如图中a点处c(CH4):c(CO)=1:1
C.容器内压强不随时间的变化而变化
D.单位时间内每生成0.3 mol H2,同时消耗0.1 mol H2O
(1)以CH4和空气为原料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,通入b气体的电极反应式为

(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在

②已知在101kPa、25℃时,32g CH4与CO2完全反应生成乙酸,放出26.6kJ热量,其热化学方程式为
(3)CH4在高温下可与水蒸气发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g),在体积2L的密闭容器中冲入一定量CH4和水蒸气,反应中测得CH4和CO物质的量随时间变化如图所示:

①从3 min到12 min,v(H2)=
②能说明上述反应达到化学平衡状态的是
A.CH4的体积分数保持不变
B.如图中a点处c(CH4):c(CO)=1:1
C.容器内压强不随时间的变化而变化
D.单位时间内每生成0.3 mol H2,同时消耗0.1 mol H2O
您最近一年使用:0次



