名校
解题方法
1 . 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________ 。
(2)已知:
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的△H=
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____ 、_____ ,CO2的平衡转化率为______ 。
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为

①____________________________________ 。
②____________________________________ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
(2)已知:
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g)
 Si(s)+4HCl(g),该反应的△H=
Si(s)+4HCl(g),该反应的△H=(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为

①
②
您最近一年使用:0次
名校
解题方法
2 . (1)已知甲烷的燃烧热是890 kJ/mol,且1 mol H2O由气态变为液态时放出44 kJ的能量。请写出甲烷燃烧生成水蒸气的热化学反应方程式为:____________________________ ;
(2)由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲中作正极的是__________________ (填“A”或“B”) ;
②装置乙溶液中C电极反应:__________________________________ ;
③装置丙中金属A上电极反应属于______________ (填“氧化反应”或“还原反应”);
④四种金属活动性由强到弱的顺序是___________________________ 。
(2)由A、B、C、D四种金属按下表中装置进行实验。
| 装置 |  |  |  |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是
②装置乙溶液中C电极反应:
③装置丙中金属A上电极反应属于
④四种金属活动性由强到弱的顺序是
您最近一年使用:0次
解题方法
3 . 氮及其化合物在化肥、医药、材料和国防工业中具有广泛应用。回答下列问题:
(1)自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。写出实验室制备氨气的方程式_________ 。
(2)有人设想寻求合适的催化剂和电极材料,以 、
、 为电极反应物,以
为电极反应物,以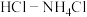 为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。

①a电极是该电池的_______ (填正极或者负极);该电池正极的电极反应式是___________ 。
②该电池在工作过程中 的浓度将不断
的浓度将不断_________ (填增大或减小),假设放电过程中电解质溶液的体积不变,当溶液中 的物质的量改变
的物质的量改变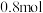 时,理论上电池能为外电路提供
时,理论上电池能为外电路提供___________ mol电子。
(3)肼 又称为联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池以20%~30%的
又称为联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池以20%~30%的 溶液为电解质溶液,总反应方程式为:
溶液为电解质溶液,总反应方程式为: 。请写出该电池放电时,负极的电极反应式:
。请写出该电池放电时,负极的电极反应式:__________ 。
(4)为了监测空气中NOx的含量,科学家成功研制出了一种NOx传感器,其工作原理示意图如图:
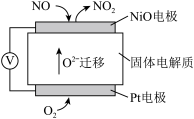
①固体电解质中 移向
移向___________ (填“正极”或“负极”)
②写出 电极发生的电极反应式:
电极发生的电极反应式:________ 。
(1)自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。写出实验室制备氨气的方程式
(2)有人设想寻求合适的催化剂和电极材料,以
 、
、 为电极反应物,以
为电极反应物,以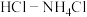 为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
①a电极是该电池的
②该电池在工作过程中
 的浓度将不断
的浓度将不断 的物质的量改变
的物质的量改变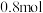 时,理论上电池能为外电路提供
时,理论上电池能为外电路提供(3)肼
 又称为联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池以20%~30%的
又称为联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池以20%~30%的 溶液为电解质溶液,总反应方程式为:
溶液为电解质溶液,总反应方程式为: 。请写出该电池放电时,负极的电极反应式:
。请写出该电池放电时,负极的电极反应式:(4)为了监测空气中NOx的含量,科学家成功研制出了一种NOx传感器,其工作原理示意图如图:

①固体电解质中
 移向
移向②写出
 电极发生的电极反应式:
电极发生的电极反应式:
您最近一年使用:0次
解题方法
4 . 某实验室模拟以粗盐(含杂质Mg2+、Ca2+、K+和 )为原料进行生产并综合利用的某过程如下图所示。已知:Ksp[Mg(OH)2]=5.6×10-12;Ksp[CaMg(CO3)2]<< Ksp[Mg(OH)2]。
)为原料进行生产并综合利用的某过程如下图所示。已知:Ksp[Mg(OH)2]=5.6×10-12;Ksp[CaMg(CO3)2]<< Ksp[Mg(OH)2]。
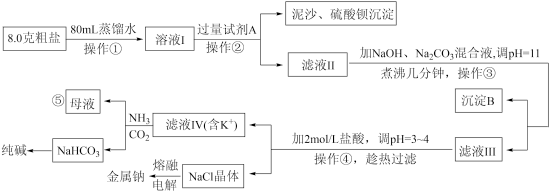
(1)过量试剂A是_________________________ 溶液。(填名称)
(2)图为KCI和NaCl的溶解度曲线,连续操作④是_____________________________ 。

(3)向滤液IV中通入NH3CO2气体后能够得到NaHCO3的原因是_______________ (用必要的化学用语和文字说明)。
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka=3×10-8,工业上用饱和纯碱溶液代替烧碱溶液与Cl2反应生产有效成分为次氯酸钠的消毒液,反应的化学方程式是___________________________________ 。
(5)经检测,滤液Ⅲ中c(Mg2+)<1.0×10-7mol/L,则镁元素最终沉淀物是_________________ 。
(6)⑤处母液可以生产氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工业上制备NCl3的一种方法是用图所示装置电解,其原理是NH4Cl+2HCl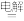 NC13十3H2↑。
NC13十3H2↑。
阳极反应式是___________________________________ 。
(7)电解氯化钠时需要加入一定量氯化钙,根据学习过的电解知识推测加入氯化钙的主要作用是_____________ 。
 )为原料进行生产并综合利用的某过程如下图所示。已知:Ksp[Mg(OH)2]=5.6×10-12;Ksp[CaMg(CO3)2]<< Ksp[Mg(OH)2]。
)为原料进行生产并综合利用的某过程如下图所示。已知:Ksp[Mg(OH)2]=5.6×10-12;Ksp[CaMg(CO3)2]<< Ksp[Mg(OH)2]。
(1)过量试剂A是
(2)图为KCI和NaCl的溶解度曲线,连续操作④是

(3)向滤液IV中通入NH3CO2气体后能够得到NaHCO3的原因是
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka=3×10-8,工业上用饱和纯碱溶液代替烧碱溶液与Cl2反应生产有效成分为次氯酸钠的消毒液,反应的化学方程式是
(5)经检测,滤液Ⅲ中c(Mg2+)<1.0×10-7mol/L,则镁元素最终沉淀物是
(6)⑤处母液可以生产氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工业上制备NCl3的一种方法是用图所示装置电解,其原理是NH4Cl+2HCl
 NC13十3H2↑。
NC13十3H2↑。
阳极反应式是
(7)电解氯化钠时需要加入一定量氯化钙,根据学习过的电解知识推测加入氯化钙的主要作用是
您最近一年使用:0次
2020-05-27更新
|
1008次组卷
|
2卷引用:辽宁省部分中学2019-2020高一下学期期末考试化学试题
名校
解题方法
5 . 镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、 GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________ 。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________ 。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+ NH3(g)=GaN(s)+3HCl(g) ∆H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g) ∆H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) ∆H3
由上述反应可知∆H3=_____________ 。
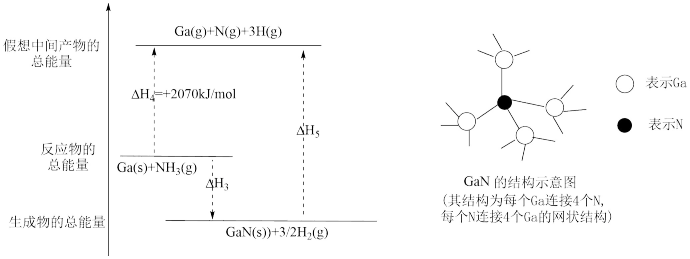
已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____ molGa-N键,拆开lmolGa-N键所需能量为______ kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:
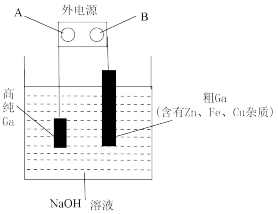
已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____ 极,电解精炼镓时产生阳极泥的主要成分是___________ 。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________ 。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________ 。(η=生成目标产物消耗的电子数÷转移的电子总数)。
(1)请画出Ga的原子结构示意图
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+ NH3(g)=GaN(s)+3HCl(g) ∆H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g) ∆H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) ∆H3
由上述反应可知∆H3=

已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:

已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=
您最近一年使用:0次
名校
解题方法
6 . 过氧化氢(H2O2)俗称双氧水。是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业。回答下列问题:
(1)H2O2的电子式为_______________ 。
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜。
已知:Cu(s)+2H+(aq)==Cu2+(aq)+H2(g)∆H=+64kJ/mol
2H2O2(1)==2H2O(l)+O2(g)∆H=-196kJmol
H2(g)+ O2(g)==H2O(l)∆H=-286kJ/mol
O2(g)==H2O(l)∆H=-286kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:__________________ 。
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4 (NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物。则:
(NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物。则:
①电解时阳极的电极反应式为___________________ ;
②(NH4)2S2O8水解时发生反应的化学方程式为____________________ 。
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
甲、乙两小组得出如下图数据。
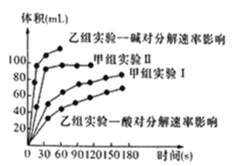
①甲小组实验得出的结论是______________________ 。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在________ (填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为_______________ ;支持这一方案的理由是_______________________ 。
③已知过氧化氢还是一种极弱的二元酸:H2O2 H++
H++ (Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
 +H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c(
+H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c( ),其中k正、k逆为速率常数,则k正与k逆的比值为
),其中k正、k逆为速率常数,则k正与k逆的比值为_________ (保留3位有效数字)。
(1)H2O2的电子式为
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜。
已知:Cu(s)+2H+(aq)==Cu2+(aq)+H2(g)∆H=+64kJ/mol
2H2O2(1)==2H2O(l)+O2(g)∆H=-196kJmol
H2(g)+
 O2(g)==H2O(l)∆H=-286kJ/mol
O2(g)==H2O(l)∆H=-286kJ/mol则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4
 (NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物。则:
(NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物。则:①电解时阳极的电极反应式为
②(NH4)2S2O8水解时发生反应的化学方程式为
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
| 实验编号 | 温度 | 催化剂 | 浓度 |
| 甲组实验I | 25℃ | 三氧化二铁 | 10mL5%H2O2 |
| 甲组实验II | 25℃ | 二氧化锰 | 10mL5%H2O2 |

①甲小组实验得出的结论是
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在
③已知过氧化氢还是一种极弱的二元酸:H2O2
 H++
H++ (Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
 +H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c(
+H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c( ),其中k正、k逆为速率常数,则k正与k逆的比值为
),其中k正、k逆为速率常数,则k正与k逆的比值为
您最近一年使用:0次
2017-06-03更新
|
387次组卷
|
2卷引用:湖南省长沙市长郡中学2017届高三高考模拟卷二理综化学试题



