1 . SO2排放至空气中会造成大气污染,某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
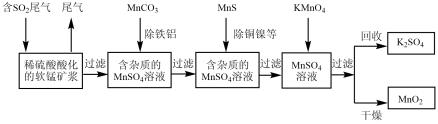
请回答下列问题:
(1)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
根据以上信息写出用MnO2脱硫的热化学方程式是______
(2)第二步加入MnCO3其原因是______
(3)若最后一步所加KMnO4恰好反应完全,如何证明过滤所得的MnO2固体已洗涤干净:______

请回答下列问题:
(1)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
根据以上信息写出用MnO2脱硫的热化学方程式是
(2)第二步加入MnCO3其原因是
(3)若最后一步所加KMnO4恰好反应完全,如何证明过滤所得的MnO2固体已洗涤干净:
您最近一年使用:0次
2019-08-10更新
|
399次组卷
|
2卷引用:2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业
名校
2 . (1)现有下列11种物质:
①纯碱②Mn2O7③硫酸④CaO⑤CO2⑥Na2CO3
⑦CuSO4·5H2O⑧SO2⑨Na2O2⑩CO⑪NO2
其中属于正盐的是______________ ;属于酸性氧化物的是__________________ 。
(2)有关胶体的实验中:
①实验室制备Fe(OH)3胶体的化学方程式为_________
②将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极负极橘红色加深,证明Sb2S3胶粒带______ (填“正”或“负”)电荷。
①纯碱②Mn2O7③硫酸④CaO⑤CO2⑥Na2CO3
⑦CuSO4·5H2O⑧SO2⑨Na2O2⑩CO⑪NO2
其中属于正盐的是
(2)有关胶体的实验中:
①实验室制备Fe(OH)3胶体的化学方程式为
②将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极负极橘红色加深,证明Sb2S3胶粒带
您最近一年使用:0次
名校
3 . 某兴趣小组探究Ba(OH)2溶液和 H2SO4溶液发生的是离子反应,设计的实验装置和实验测定的导电性曲线分别如图所示。下列有关说法错误的是
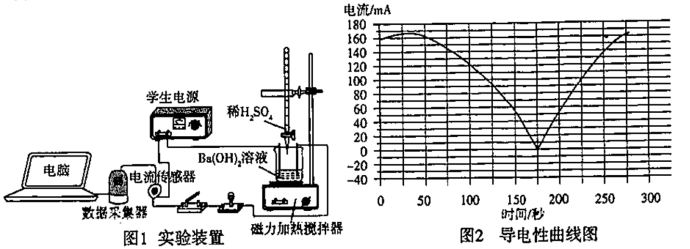

A.该反应的离子方程式是 Ba2+ +2OH- +SO +2H+=BaSO4↓+ 2H2O +2H+=BaSO4↓+ 2H2O |
| B.反应在经历大约270秒时,放出的热量也达到最大值。 |
| C.导电能力最低点表示 Ba(OH)2溶液和 H2SO4溶液恰好完全反应 |
| D.用盐酸代替H2SO4溶液,测得的导电性曲线和上述曲线相同 |
您最近一年使用:0次
2020-11-19更新
|
305次组卷
|
4卷引用:山东省潍坊市诸城一中2021届高三11月份模拟化学试题
山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)2.2.2 离子方程式的书写-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)湖南省长沙市雅礼中学2021 -2022学年上学期高一12月月考化学试题湖南省常德市临澧县第一中学2022-2023学年高一上学期第一次阶段性考试化学试题
4 . 甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g) CH3OH(g) △H1=-99kJ•mol-1
CH3OH(g) △H1=-99kJ•mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:CH3OH结构式
(1)该反应△H2=____________ 。
(2)关于反应①下列说法,正确的是____________ 。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如图所示:

①从反应开始到5min时,生成甲醇的平均速率为____________ 。
②H2的平衡转化率α=____________ %,化学平衡常数K=____________ 。
③1min时,υ正____________ υ逆(填“大于”“小于”或“等于”)
④1min时υ正____________ 4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小____________ 。
⑥若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数____________ 0.1(填“>”、“<”或“=”)。
①CO(g)+2H2(g)
 CH3OH(g) △H1=-99kJ•mol-1
CH3OH(g) △H1=-99kJ•mol-1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2相关物质的化学键键能数据如下:CH3OH结构式

| 化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
| E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=
(2)关于反应①下列说法,正确的是
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如图所示:

①从反应开始到5min时,生成甲醇的平均速率为
②H2的平衡转化率α=
③1min时,υ正
④1min时υ正
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小
⑥若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数
您最近一年使用:0次
名校
解题方法
5 . 一氧化碳甲烷化反应为:CO(g) + 3H2(g) = CH4(g) + H2O(g)。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。
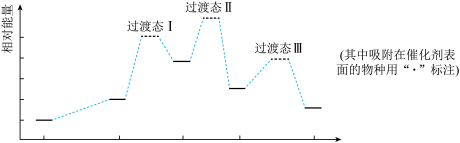
CO(g)+H2(g) CO(g)+·H
CO(g)+·H  ·CHO
·CHO  ·CH+H2O(g→CH4(g)
·CH+H2O(g→CH4(g)
下列说法不正确的是

CO(g)+H2(g)
 CO(g)+·H
CO(g)+·H  ·CHO
·CHO  ·CH+H2O(g→CH4(g)
·CH+H2O(g→CH4(g)下列说法不正确的是
| A.步骤①只有非极性键断裂 |
| B.步骤②的原子利用率为 100% |
| C.过渡态Ⅱ能量最高,因此其对应的步骤③反应速率最慢 |
| D.该方法可以清除剧毒气体CO,从而保护环境 |
您最近一年使用:0次
2020-07-01更新
|
449次组卷
|
3卷引用:北京市海淀区北京大学附中2020 届高三化学阶段性测试化学试题
北京市海淀区北京大学附中2020 届高三化学阶段性测试化学试题(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编山东省烟台第二中学2021-2022学年高一3月月月考化学试题
19-20高二·浙江·期末
6 .  是汽车尾气中的主要污染物之一,硝酸盐是水体污染的污染物之一。
是汽车尾气中的主要污染物之一,硝酸盐是水体污染的污染物之一。
(1) 可用于烟气脱硝。已知有如下反应:
可用于烟气脱硝。已知有如下反应:
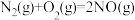
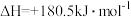


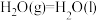
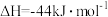
则

________ 
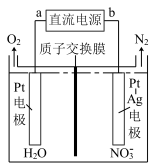
(2)电化学降解 的原理如图所示,电源正极为
的原理如图所示,电源正极为________ (填“a”或"b"),阴极电极反应式________ 。
(3)某研究小组在100°C时,将 充入2L的真空密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到如下数据
充入2L的真空密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到如下数据
①上述条件下,对于 的说法正确的是
的说法正确的是________ 。
A.该反应为吸热反应
B. ,
,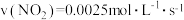
C.
D.该反应的平衡常数为2.8(保留小数点后一位)
②在相同情况下,最初向该容器中充入的是 ,要达到相同的平衡状态,
,要达到相同的平衡状态, 的起始浓度是
的起始浓度是________  。在80s时达到平衡,请在图中画出并标明
。在80s时达到平衡,请在图中画出并标明 和
和 的浓度随时间变化(0-100s)的曲线。
的浓度随时间变化(0-100s)的曲线。______________

③反应 达到平衡后,向该密闭容器中再充入0.32mol氮气,并把容器体积扩大为4L,判断平衡如何移动并解释原因
达到平衡后,向该密闭容器中再充入0.32mol氮气,并把容器体积扩大为4L,判断平衡如何移动并解释原因________ 。
 是汽车尾气中的主要污染物之一,硝酸盐是水体污染的污染物之一。
是汽车尾气中的主要污染物之一,硝酸盐是水体污染的污染物之一。(1)
 可用于烟气脱硝。已知有如下反应:
可用于烟气脱硝。已知有如下反应: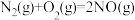
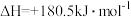


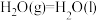
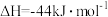
则



(2)电化学降解
 的原理如图所示,电源正极为
的原理如图所示,电源正极为
(3)某研究小组在100°C时,将
 充入2L的真空密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到如下数据
充入2L的真空密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到如下数据| 时间(s) | 0 | 20 | 40 | 60 | 80 |
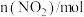 | 0.40 | 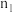 | 0.26 |  |  |
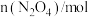 | 0.00 | 0.05 |  | 0.08 | 0.08 |
①上述条件下,对于
 的说法正确的是
的说法正确的是A.该反应为吸热反应
B.
 ,
,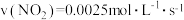
C.

D.该反应的平衡常数为2.8(保留小数点后一位)
②在相同情况下,最初向该容器中充入的是
 ,要达到相同的平衡状态,
,要达到相同的平衡状态, 的起始浓度是
的起始浓度是 。在80s时达到平衡,请在图中画出并标明
。在80s时达到平衡,请在图中画出并标明 和
和 的浓度随时间变化(0-100s)的曲线。
的浓度随时间变化(0-100s)的曲线。
③反应
 达到平衡后,向该密闭容器中再充入0.32mol氮气,并把容器体积扩大为4L,判断平衡如何移动并解释原因
达到平衡后,向该密闭容器中再充入0.32mol氮气,并把容器体积扩大为4L,判断平衡如何移动并解释原因
您最近一年使用:0次
7 . 为了防止氮氧化物对空气的污染,人们采取了很多措施。
(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
①下列有关说法正确的是_________ 。
A. 在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B. 恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C. 体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D. 恒温恒压时,充入氩气有利于提高氮氧化物的转化率
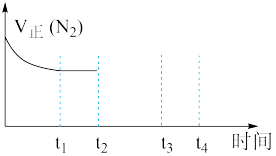
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在如图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:____________
(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g) N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________ 。
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=_______________ 。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如P(NO2)为NO2的平衡分压,P(NO2)=x(NO2)P, P为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为_____________ 。

(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。①下列有关说法正确的是
A. 在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B. 恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C. 体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D. 恒温恒压时,充入氩气有利于提高氮氧化物的转化率
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在如图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:

(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g)
 N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染| 反应 | 25℃时的平衡常数 | 焓变 |
反应I:2NO(g) N2(g)+O2(g) N2(g)+O2(g) | K1=1×1030 | ΔH=-180.5kJ/mol |
反应II:2CO2 (g) 2CO(g)+O2(g) 2CO(g)+O2(g) | K2=4×10-92 | ΔH= +566.0kJ/mol |
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g)
 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为

您最近一年使用:0次
解题方法
8 . 硫在自然界的循环过程如图所示,下列说法错误的是


| A.氢、氧两种元素也参与了硫的循环 |
| B.在生成硫酸的过程中,SO2发生还原反应 |
| C.工厂产生的含SO2的烟气应经脱硫处理以减少环境污染 |
| D.火山气体中的H2S和SO2可以发生如下反应:2H2S+SO2=3S+2H2O,氧化产物与还原产物的物质的量之比为2:1 |
您最近一年使用:0次
2020-08-17更新
|
206次组卷
|
2卷引用:云南省昆明市2019-2020学年高二下学期期末质量检测化学试题
9 . 氢气是一种清洁能源,请根据实验室和工业上制氢及氢气性质回答相关问题。
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是______________ ;
(2)要加快上述实验中产生氢气的速率,还可采取的措施有______ 、_______ (列举两种措施)。
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因____________ 。
II.工业上海水制氢气的新技术:2H2O 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:
(1)分解海水的反应属于_____ 反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的____ 极。
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2 HCOONa+H2O。下列有关说法正确的是
HCOONa+H2O。下列有关说法正确的是____ 。
A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是
(2)要加快上述实验中产生氢气的速率,还可采取的措施有
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因
II.工业上海水制氢气的新技术:2H2O
 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:(1)分解海水的反应属于
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2
 HCOONa+H2O。下列有关说法正确的是
HCOONa+H2O。下列有关说法正确的是A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
您最近一年使用:0次
名校
10 . 通过CH4超干重整CO2技术可得到富含CO的化工原料,其过程如下图所示。下列说法错误的是( )
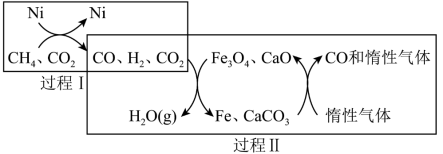
A.过程Ⅰ的化学方程式为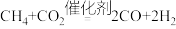 |
B.过程Ⅱ的化学方程式为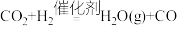 |
| C.该技术实现了含碳物质与含氢物质的分离 |
| D.Ni、Fe、CaCO3均是上述过程中用到的催化剂 |
您最近一年使用:0次
2019-10-13更新
|
2136次组卷
|
6卷引用:河南省大象联考2020届高三高考质量测评化学试题



