解题方法
1 . 研究NOx、SO2等大气污染物的妥善处理对于解决化学污染问题具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收。吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
②NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=bkJ•mol-1
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(ag) ΔH3=ckJ•mol-1
则反应SO2(g)+2NH3•H2O(aq)+ O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=
O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=___ 。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:
2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:
0~10min内,平均反应速率v(O2)=___ mol•L-1•min-1。
(3)NOx的排放主要来自于汽车尾气,有人用活性炭对NO进行吸附,反应为C(s)+2NO(g) N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
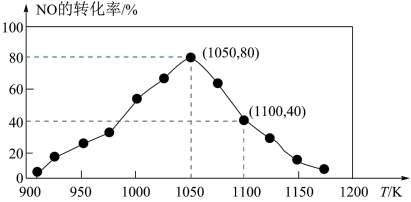
①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因是___ ;在1100K时,CO2的体积分数为___ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___ (已知:气体分压(P分)气体总压(P)×体积分数)
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,只升高温度,k正增大的倍数___ (填“>”,“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =
=___ 。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收。吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
②NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=bkJ•mol-1
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(ag) ΔH3=ckJ•mol-1
则反应SO2(g)+2NH3•H2O(aq)+
 O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=
O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)
 2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:
2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:| 时间/min 浓度/mol▪L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
(3)NOx的排放主要来自于汽车尾气,有人用活性炭对NO进行吸附,反应为C(s)+2NO(g)
 N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因是
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。①达到平衡后,只升高温度,k正增大的倍数
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则
 =
=
您最近一年使用:0次
2 . 研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减弱温室效应具有重要的意义。
工业上CO2与CH4发生反应Ⅰ:CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g) H2O(g)+CO(g) ∆H2=+41 kJ·mol−1
H2O(g)+CO(g) ∆H2=+41 kJ·mol−1
(1)已知部分化学键的键能数据如下表所示:
则∆Hl =_______ kJ·mol−1,反应Ⅰ在一定条件下能够自发进行的原因是________________ ,该反应工业生产适宜的温度和压强为_______ (填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1∶1投料制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923 K时CO2的平衡转化率大于CH4的原因是________________________ 。
②计算923 K时反应Ⅱ的化学平衡常数K=______ (计算结果保留小数点后两位)。
③1200 K以上CO2和CH4的平衡转化率趋于相等的原因可能是_______________ 。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______________________ 。

②为了提高该反应中CH4的转化率,可以采取的措施是________________________ 。
(4)高温电解技术能高效实现下列反应:CO2+H2O CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式_____ 。
工业上CO2与CH4发生反应Ⅰ:CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)
 H2O(g)+CO(g) ∆H2=+41 kJ·mol−1
H2O(g)+CO(g) ∆H2=+41 kJ·mol−1(1)已知部分化学键的键能数据如下表所示:
| 化学键 | C—H | H—H | C=O |  |
| 键能(kJ·mol−1) | 413 | 436 | 803 | 1076 |
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1∶1投料制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923 K时CO2的平衡转化率大于CH4的原因是
②计算923 K时反应Ⅱ的化学平衡常数K=
③1200 K以上CO2和CH4的平衡转化率趋于相等的原因可能是
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是

②为了提高该反应中CH4的转化率,可以采取的措施是
(4)高温电解技术能高效实现下列反应:CO2+H2O
 CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO2在电极a放电的电极反应式
您最近一年使用:0次
解题方法
3 . 2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕。一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO) 等一碳化合物在化工 、医药,能源等方面都有着广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1molHCHO过程中能量变化如图1。
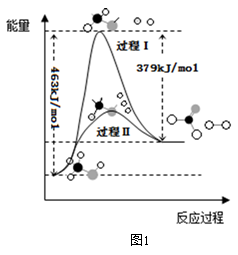
已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ•mol-1,则反应CO2(g)+2H2(g)=HCHO(g) +H2O(g) △H=___________ kJ•mol-1。
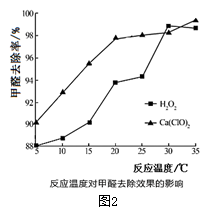
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为__________ (填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g) CH3OH(g) △H=akJ•mol-1
CH3OH(g) △H=akJ•mol-1
①按 =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a_____ (填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________ 。
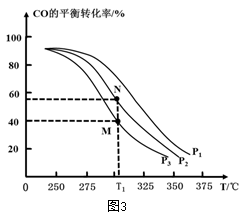
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol•L-1。达到平衡时,CO的转化率为图3中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为__________ (保留3位有效数字)。
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取H2:CH4(g) +H2O(g) CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
由上还数据可得该温度下,c2=____________ ,该反应的逆反应速率常数k=______ L3•mol-3•min-1)。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1molHCHO过程中能量变化如图1。

已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ•mol-1,则反应CO2(g)+2H2(g)=HCHO(g) +H2O(g) △H=
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为

(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g)
 CH3OH(g) △H=akJ•mol-1
CH3OH(g) △H=akJ•mol-1①按
 =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol•L-1。达到平衡时,CO的转化率为图3中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取H2:CH4(g) +H2O(g)
 CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJ•mol-1,该中反应的逆反应速率及表达式为v逆=k•c(CO)•c3(H2),k为速率常数,在某温度下测得实验数据如表所示,| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 8.0 |
| c2 | c1 | 16.0 |
| c2 | 0.15 | 6.75 |
由上还数据可得该温度下,c2=
您最近一年使用:0次
解题方法
4 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
(1)CO2加氢合成低碳烯烃技术能有效利用CO2,以合成C2H4为例。该转化分为两步进行:
第一步:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.3kJ/mol
CO(g)+H2O(g) ΔH1=+41.3kJ/mol
第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
CO2加氢合成乙烯的热化学方程式为__ 。
(2)利用CO2和H2合成甲醇又是一个有效利用CO2的途径,反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
①在容积为2L的恒容密闭容器中,通入2molCO2和3molH2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__ (填字母)
a.消耗1.5molH2时,有0.5molCH3OH生成
b.转移3mol电子时,消耗11.2L(标准状况下)CO2
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2与生成H2O的物质的量之比为3:1
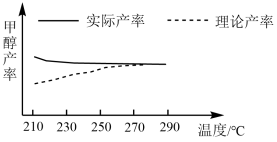
②研究温度对该反应甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速发生上述反应。得到甲醇平衡产率与温度的关系如图所示,ΔH3__ 0(填“>”、“=”或“<”)。判断依据是__ 。
③在一固定容积的密闭容器中发生上述反应。若要提高平衡时CH3OH产率,则可以采取的措施是__ (填字母)。
a.升温 b.加入催化剂 c.增加CO2的浓度 d.加入H2加压 e.加入惰性气体 f.分离出甲醇
(3)在一定温度和催化剂作用下,也可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g) CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到平衡,此时各物质的浓度如下表:
则a=__ ,该反应平衡常数K=__ 。
(4)以TiO2/Cu2Al2O4为催化剂,利用CH4可以将CO2直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示,乙酸的生成速率主要取决于温度影响的范围是__ 。250~300℃时,温度升高而乙酸的生成速率降低的原因是__ 。
(1)CO2加氢合成低碳烯烃技术能有效利用CO2,以合成C2H4为例。该转化分为两步进行:
第一步:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41.3kJ/mol
CO(g)+H2O(g) ΔH1=+41.3kJ/mol第二步:2CO(g)+4H2(g)
 C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
C2H4(g)+2H2O(g) ΔH2=-210.5kJ/molCO2加氢合成乙烯的热化学方程式为
(2)利用CO2和H2合成甲醇又是一个有效利用CO2的途径,反应如下:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3①在容积为2L的恒容密闭容器中,通入2molCO2和3molH2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是
a.消耗1.5molH2时,有0.5molCH3OH生成
b.转移3mol电子时,消耗11.2L(标准状况下)CO2
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2与生成H2O的物质的量之比为3:1
②研究温度对该反应甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速发生上述反应。得到甲醇平衡产率与温度的关系如图所示,ΔH3

③在一固定容积的密闭容器中发生上述反应。若要提高平衡时CH3OH产率,则可以采取的措施是
a.升温 b.加入催化剂 c.增加CO2的浓度 d.加入H2加压 e.加入惰性气体 f.分离出甲醇
(3)在一定温度和催化剂作用下,也可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到平衡,此时各物质的浓度如下表:| 物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
| 浓度/mol·L-1 | 0.2 | 0.8 | a | 1.6 |
则a=
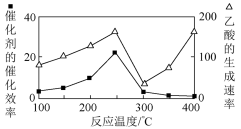
(4)以TiO2/Cu2Al2O4为催化剂,利用CH4可以将CO2直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示,乙酸的生成速率主要取决于温度影响的范围是

您最近一年使用:0次
2020-06-09更新
|
183次组卷
|
2卷引用:甘肃省兰州市2020届高三诊断考试理科综合化学试题
名校
解题方法
5 . K2 FeO4在水中不稳定,发生反应: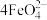 +l0H2O
+l0H2O 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
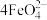 +l0H2O
+l0H2O 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 
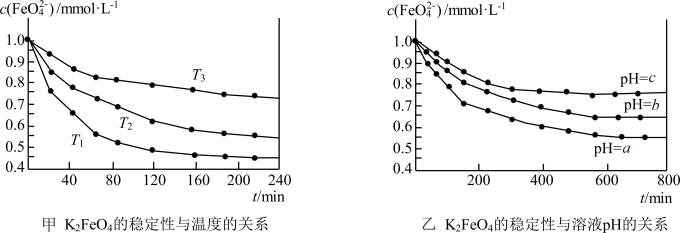
| A.由图甲可知上述反应 △H < 0 |
| B.由图甲可知温度:T1 > T2 > T3 |
| C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱 |
| D.由图乙可知图中a < c |
您最近一年使用:0次
2019-12-29更新
|
656次组卷
|
5卷引用:【全国百强校】甘肃省兰州市第一中学2018届高三考前最后冲刺模拟化学试题
6 . 碳热还原法广泛用于合金及材料的制备。回答下列问题:
(1)一种制备氮氧化铝的反应原理为23Al2O3+ 15C+5N2=2Al23O27N5+15CO,产物Al23O27N5中氮的化合价为_______ 。
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3 (s)+ 3C(s)=Al2OC(s)+2CO(g) △H1
2Al2OC(s) + 3C(s)=Al4C3(s) + 2CO(g) △H2
2Al2O3 (s)+ 9C(s)= Al4C3 (s) + 6CO(g) △H3
①△H3=_______ (用△H1、△H2表示)。
②Al4C3可与足量盐酸反应制备一种最简单的烃,该反应的化学方程式为_______ 。
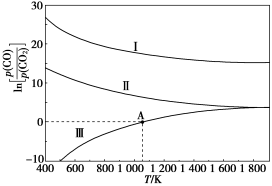
(3)下列是碳热还原制锰合金的三个反应,CO 与CO2平衡分压比的自然对数值(1nK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数。分压=总压× 气体的物质的量分数)。
I.Mn3C(s)+4CO2(g) 3MnO(s)+5CO(g) Kp(I)
3MnO(s)+5CO(g) Kp(I)
II.Mn(s)+CO2(g) MnO(s)+CO(g) Kp(II)
MnO(s)+CO(g) Kp(II)
III.Mn3C(s) + CO2(g) 3Mn(s)+2CO(g) Kp(III)
3Mn(s)+2CO(g) Kp(III)
①△H>0 的反应是_______ (填“I”“II”或“III”)。
②1200 K时,在一体积为2L的恒容密闭容器中有17.7 gMn3C(s)和0.4molCO2,只发生反应I,5min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min 内v (CO2)=_______ 。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应II,下列能说明反应II达到平衡的是_______ (填字母 )。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C 并充入0.1molCO2,若只发生反应III,则在A点反应达到平衡。当容器的总压为a kPa时,CO2的转化率为_______ ;A点对应温度下的Kp(III)=_______ 。
(1)一种制备氮氧化铝的反应原理为23Al2O3+ 15C+5N2=2Al23O27N5+15CO,产物Al23O27N5中氮的化合价为
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3 (s)+ 3C(s)=Al2OC(s)+2CO(g) △H1
2Al2OC(s) + 3C(s)=Al4C3(s) + 2CO(g) △H2
2Al2O3 (s)+ 9C(s)= Al4C3 (s) + 6CO(g) △H3
①△H3=
②Al4C3可与足量盐酸反应制备一种最简单的烃,该反应的化学方程式为
(3)下列是碳热还原制锰合金的三个反应,CO 与CO2平衡分压比的自然对数值(1nK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数。分压=总压× 气体的物质的量分数)。

I.Mn3C(s)+4CO2(g)
 3MnO(s)+5CO(g) Kp(I)
3MnO(s)+5CO(g) Kp(I)II.Mn(s)+CO2(g)
 MnO(s)+CO(g) Kp(II)
MnO(s)+CO(g) Kp(II)III.Mn3C(s) + CO2(g)
 3Mn(s)+2CO(g) Kp(III)
3Mn(s)+2CO(g) Kp(III)①△H>0 的反应是
②1200 K时,在一体积为2L的恒容密闭容器中有17.7 gMn3C(s)和0.4molCO2,只发生反应I,5min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min 内v (CO2)=
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应II,下列能说明反应II达到平衡的是
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C 并充入0.1molCO2,若只发生反应III,则在A点反应达到平衡。当容器的总压为a kPa时,CO2的转化率为
您最近一年使用:0次
名校
7 . 钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3和少量Fe2O3 )进行钛白粉和LiFePO4的联合生产工艺如下图所示:
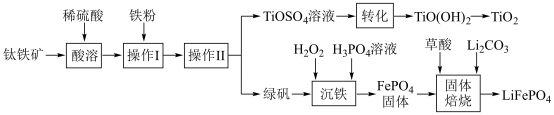
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________ 。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________ 。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________ 。操作Ⅱ为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________ 。
(4)TiO2+易水解,则其水解的离子方程式为______________________ ;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________ 。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______ mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____ 。

回答下列问题:
(1) LiFePO4中Fe的化合价是
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是
(3)用离子方程式表示操作I加入铁粉的目的:
(4)TiO2+易水解,则其水解的离子方程式为
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是
您最近一年使用:0次
2018-03-22更新
|
1219次组卷
|
10卷引用:河南省濮阳市2018届高三第二次模拟考试理综化学试题
河南省濮阳市2018届高三第二次模拟考试理综化学试题【全国百强校】河南省新乡市铁一中2019届高三上学期一轮复习阶段(八)化学试题甘肃省天水市一中2021届高三下学期5月第十次模拟考试理综化学试题河南省驻马店市正阳县高级中学2020届高三上学期第二次月考化学试题四川省树德中学2019-2020高二下学期定时检测(线上开学考试)化学试题四川省乐山市犍为第一中学2020届高三上学期模拟考试理综化学试题安徽省黄山市屯溪第一中学2019-2020学年高二下学期入学考试化学试题江西省抚州市临川第一中学2019-2020学年高二下学期第十次周测化学试题江西省景德镇一中2022-2023学年高二上学期期中考试(重点班)化学试题江西省新余市第一中学2022-20232学年高二下学期第一次段考化学试题
名校
解题方法
8 . COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g) H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
则X=_____________________ 。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________ (保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________ 。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________ ;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________ 。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+)的关系如右图所示,请回答:
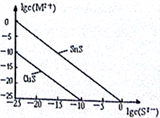
①25℃时Ksp(CuS)=_______________ 。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________ mol/L。
Ⅰ.COS(g)+H2(g)
 H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;I.CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
| H2CO3 | H2S | |
| Ka1 | 4.4× 10-7 | 1.3×10-7 |
| Ka2 | 4.7× 10-11 | 7.1×10-15 |
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+)的关系如右图所示,请回答:

①25℃时Ksp(CuS)=
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为
您最近一年使用:0次
2018-02-01更新
|
413次组卷
|
2卷引用:甘肃省兰化一中2018届高三下学期第二次模拟理综化学试题
名校
解题方法
9 . H2X 和H2Y均为二元弱酸,常温下,将NaOH 溶液分别加到H2X 和H2Y的溶液中,在不同pH 环境下不同形态的粒子(即酸、酸式酸根、酸根离子)的组成分数如图所示:

下列说法正确的是

下列说法正确的是
| A.在pH=7的溶液中HX-、X2−、HY-和Y2−能大量共存 |
| B.向Na2X溶液中加入少量H2Y 溶液,发生反应:X2−+H2Y=HX-+HY- |
| C.1L.0.1 mol∙L−1NaHY溶液中n(HY-)+2n(Y2−)+n(H2Y) =0.1mol |
| D.HX-的水解平衡常数为Kb=10−7 |
您最近一年使用:0次
2018-01-20更新
|
437次组卷
|
3卷引用:甘肃省兰化一中2018届高三下学期第二次模拟理综化学试题
名校
10 . “绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
②N2(g)+O2(g) 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g) 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________ 以及此热化学方程式的平衡常数K=____________ (用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=
,则反应开始到平衡时CO的平均反应速率v(CO)=________ 。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________ 。
(3)电化学降解NO2-的原理如下图:
①电源的负极是________ (填A或B)阴极反应式为________________________________________ 。
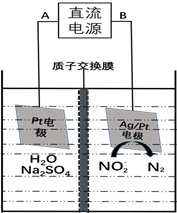
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差 为
为_________ g。
(1)已知:①NO2 + CO
 CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为 NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)
 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2 ③2NO(g) +O2(g)
 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3试写出NO与CO反应生成无污染物气体的热化学方程式
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO
 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=
,则反应开始到平衡时CO的平均反应速率v(CO)=若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围
(3)电化学降解NO2-的原理如下图:
①电源的负极是

②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差
 为
为
您最近一年使用:0次
2017-12-09更新
|
532次组卷
|
5卷引用:甘肃省张掖市2018届高三第三次诊断考试化学试题



