四川省乐山市犍为第一中学2020届高三上学期模拟考试理综化学试题
四川
高三
阶段练习
2020-04-14
282次
整体难度:
适中
考查范围:
化学与STSE、有机化学基础、认识化学科学、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质
四川省乐山市犍为第一中学2020届高三上学期模拟考试理综化学试题
四川
高三
阶段练习
2020-04-14
282次
整体难度:
适中
考查范围:
化学与STSE、有机化学基础、认识化学科学、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 化学与生活、环境密切相关,下列说法错误的是
| A.享有“镇国之宝”称谓的“司母戊鼎”属于青铜制品 |
| B.“煤改气”可以减少SO2等有害物质的排放量,有利于“雾霾”天气的治理 |
| C.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
| D.做油条用的膨松剂不应含明矾 |
【知识点】 合理安排饮食解读 大气污染的治理原理及方法解读 金属材料的性质及利用
您最近一年使用:0次
单选题
|
适中(0.65)
名校
2. 乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如下图:
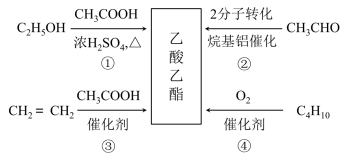
| A.反应①、②均是取代反应 |
| B.反应③、④的原子利用率均为100% |
| C.与乙酸乙酯互为同分异构体的酯类化合物有2种 |
| D.乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别 |
您最近一年使用:0次
2022-04-30更新
|
1323次组卷
|
26卷引用:【市级联考】四川省攀枝花市2019届高三下学期第三次统考理科综合化学试题
【市级联考】四川省攀枝花市2019届高三下学期第三次统考理科综合化学试题安徽省六安市舒城中学2018-2019学年高二下学期期末考试化学试题课时2 乙醇——A学习区 夯实基础(鲁科版必修2)课时2 乙酸——A学习区 夯实基础(鲁科版(2019)第二册)四川省乐山市犍为第一中学2020届高三上学期模拟考试理综化学试题长春吉大附中实验学校高二下学期网上学习效果检测化学试题河北省邢台市内丘中学2019-2020学年高二下学期第二次月考化学试题河南省商丘市第一高级中学2019-2020高二下学期期中考试化学试题江西省九江市都昌县狮山中学2019-2020学年高二下学期五月摸底测试化学试题河北省唐山市玉田县第一中学2019-2020学年高二下学期期末考试化学试题江苏省常州市第二中学2020-2021学年高二上学期期中联合调研考试化学试题河南省南阳市2020-2021学年高一下学期期终质量联考化学试题(已下线)考点28 饮食中的常见的有机物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点27 饮食中的常见的有机物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时47 乙醇 乙酸-2022年高考化学一轮复习小题多维练(全国通用)河北省保定市唐县第一中学2021-2022学年高二(实验部)上学期期中考试化学试题湖南省怀化市沅陵县第一中学2021-2022学年高三下学期第二次模拟考试化学试题(已下线)押新高考卷04题 有机化学基础-备战2022年高考化学临考题号押题(新高考通版)湖南省益阳市第一中学2021-2022学年高三下学期第三次模拟考试化学试题江西省九江第一中学2021-2022学年高二下学期5月月考化学试题吉林省长春外国语学校2021-2022学年高二下学期期中考试化学试题山东省德州市2021-2022学年高二下学期春季延迟开学学情调研化学试题期末学业水平检测(二)山东省烟台莱州市第一中学2022-2023学年高二下学期3月月考化学试题江苏省锡东高级中学2023-2024学年高二上学期期末考试化学试卷河北省石家庄市河北正中实验中学2023-2024学年高二下学期第二次月考暨期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
3. 用NA表示阿伏加 德罗常数的值。下列叙述中正确的是
| A.3.2gO2与钠完全反应后,生成的阴离子的总数为0.2NA |
| B.0.1mol氯气完全溶于水后,溶液中Cl-、HClO数目之和为0.2NA |
| C.1.7g氨气与2.24L氨气中氨分子数目均为0.1NA |
| D.0.1mol 甘油(C3H8O3)与丙醇的混合物完全燃烧生成的水分子数目为0.4NA |
【知识点】 阿伏加德罗常数的应用解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
4. 下列实验操作与结论都正确且有相关性的是
| 选项 | 实验操作及现象 | 结论 |
| A | 向酸性高锰酸钾溶液中滴加适量乙醛溶液,充分振荡,紫红色褪色 | 乙醛具有还原性 |
| B | 向某溶液中滴加Ba(NO3)3溶液和盐酸,产生白色沉淀 | 该溶液含SO42- |
| C | 向品红溶液中通入气体R,溶液变无色;微热,颜色无变化 | R一定是Cl2 |
| D | 将丁烷的裂解气通入溴水中,溴水褪色 | 裂解气一定含乙烯 |
| A.A | B.B | C.C | D.D |
【知识点】 硫酸根离子的检验解读 常见阴离子的检验解读 化学实验方案的设计与评价
您最近一年使用:0次
2020-03-04更新
|
98次组卷
|
2卷引用:2019年天一大联考高三六联理综——化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 我国成功研制出一种全新的铝-石墨双离子电池(AGDIB),这种新型AGDIB电池采用廉价且易得的石墨、铝箔作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。该电池工作原理是:充电过程中,石墨发生阴离子插层反应,而铝电极发生铝-锂合金化反应,放电过程则相反。电池反应式为CxPF6+ LiyAl Cx+LiPF6+ Liy-1Al,下列说法不正确的是
Cx+LiPF6+ Liy-1Al,下列说法不正确的是
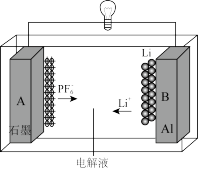
 Cx+LiPF6+ Liy-1Al,下列说法不正确的是
Cx+LiPF6+ Liy-1Al,下列说法不正确的是
| A.铝箔是电池负极 |
| B.充电时,铝电极发生铝—锂合金化反应是还原反应 |
C.充电时A作阳极,放电时A电极的电极反应式为CxPF6+e-=Cx+ |
| D.废旧AGDIB电池进行“放电处理”,让Li+进入石墨中而有利于回收 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
6. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W的最外层电子数与X、Y的最外层电子数之和相等,X在周期表中所处的周期数等于族序数,在周期表前四周期的所有主族元素中Z的原子序数最大。下列说法正确的是
| A.原子半径:Y>X>W |
| B.W、Z的最高正价之和等于8 |
| C.W、X的简单离子的电子层结构相同 |
| D.X的最高价氧化物对应水化物的碱性比Z强 |
【知识点】 元素周期律、元素周期表的推断
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
7. 四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。

下列说法正确的是

下列说法正确的是
| A.曲线1代表四甲基氢氧化铵溶液 |
| B.常温下,CH3NH3Cl水解常数的数量级为10-11 |
| C.b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O) |
| D.在b、c、e三点中,水的电离程度最大的点是e |
您最近一年使用:0次
2020-07-04更新
|
116次组卷
|
5卷引用:河南省天一大联考“顶尖计划”2019届高三第二次考试(2月) 理科综合化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
名校
8. 钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3和少量Fe2O3 )进行钛白粉和LiFePO4的联合生产工艺如下图所示:
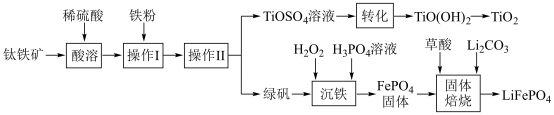
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________ 。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________ 。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________ 。操作Ⅱ为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________ 。
(4)TiO2+易水解,则其水解的离子方程式为______________________ ;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________ 。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______ mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____ 。

回答下列问题:
(1) LiFePO4中Fe的化合价是
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是
(3)用离子方程式表示操作I加入铁粉的目的:
(4)TiO2+易水解,则其水解的离子方程式为
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是
您最近一年使用:0次
2018-03-22更新
|
1219次组卷
|
10卷引用:河南省濮阳市2018届高三第二次模拟考试理综化学试题
河南省濮阳市2018届高三第二次模拟考试理综化学试题【全国百强校】河南省新乡市铁一中2019届高三上学期一轮复习阶段(八)化学试题河南省驻马店市正阳县高级中学2020届高三上学期第二次月考化学试题四川省树德中学2019-2020高二下学期定时检测(线上开学考试)化学试题四川省乐山市犍为第一中学2020届高三上学期模拟考试理综化学试题安徽省黄山市屯溪第一中学2019-2020学年高二下学期入学考试化学试题江西省抚州市临川第一中学2019-2020学年高二下学期第十次周测化学试题甘肃省天水市一中2021届高三下学期5月第十次模拟考试理综化学试题江西省景德镇一中2022-2023学年高二上学期期中考试(重点班)化学试题江西省新余市第一中学2022-20232学年高二下学期第一次段考化学试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
9. 氮及其化合物在人们的日常生活、生产和环保事业中属于“明星物质”。回答下列问题:
(1)氨气是农业肥料和化工生产的重要原料,其电子式为____ 。
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为______________ 。
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l) 4NH3(g)+3O2(g) △H3=
4NH3(g)+3O2(g) △H3=______ kJ/mol。
(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g) 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。

①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为_____ (写化学式),反应达到平衡时的平均反应速率v(N2) =_________ 。
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1_____ p2(填“>”“<”“=”或“不确定”,下同),B、D 两点的平衡常数KB____ KD,B 点N2的转化率=_________ (保留3位有效数字)。
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3尾气,装置原理图如图丙:

负极反应式为__________ ,当有标准状况下4.48 L NO2被处理时,转移电子的物质的量为_____ mol。
(1)氨气是农业肥料和化工生产的重要原料,其电子式为
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g)
 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l)
 4NH3(g)+3O2(g) △H3=
4NH3(g)+3O2(g) △H3=(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g)
 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3尾气,装置原理图如图丙:

负极反应式为
您最近一年使用:0次
2018-04-20更新
|
691次组卷
|
2卷引用:河南省天一大联考2018届高三阶段性测试(五)(河南版) 理科综合化学试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
10. 某研究性学习小组的同学通过查阅资料获得两个信息:一是在CaO存在的条件下,干燥的NaOH与干燥的CH3COONa混合加热可得到CH4;二是在加热条件下CH4可还原CuO。他们设计如下装置(加热仪器省略)制备CH4、还原CuO并验证B中有CO2、H2O生成。
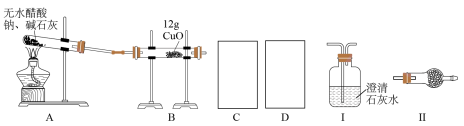
(1)为实现上述实验目的,C、D中的仪器应分别为_______________ (填"Ⅰ、Ⅱ"或"Ⅱ、Ⅰ"),Ⅱ中的试剂是________________ 。
(2)A、B处均需要加热,实验中应先加热______ 处,表明B中有CO2生成的现象是_________ 。A中另一种生成物是常见的无机盐,A中反应的化学方程式为_________ 。
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:________________ 。
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是________ ,在常用的酸中,稀硫酸能不能换成稀硝酸_________ (填“能”或“不能"),原因是_________ 。
②称量所得红色固体的质量,当固体质量(m)介于___________ 之间表明红色固体是Cu与Cu2O的混合物。

(1)为实现上述实验目的,C、D中的仪器应分别为
(2)A、B处均需要加热,实验中应先加热
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是
②称量所得红色固体的质量,当固体质量(m)介于
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
名校
11. 铜和硫的化合物在化工、医药材料等领域具有广泛的用途。回答下列问题:
(1)原子轨道是指电子在原子核外的___________ ,基态S原子的原子轨道数是____ 个。
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是______ ,占据该能级的电子数为__________ 。
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为_______ 。
(4)下图是含元素Cu、S的有机物的结构简式:

①该有机化合物结构中含有的化学键类型是_______ (填“共价键““离子键”或“共价键、离子键”)、配位键,其中1个该有机物分子中配位键数为_____ 个,这些配位键中提供孤电子对的元素是__________ 。
②S原子的杂化方式为_______ 、带*N原子的杂化方式为_______ 。
(5)下图是Cu-Au合金的一种立方晶体结构:
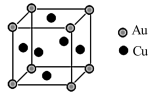
已知该合金的密度分dg/cm3,阿伏伽德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为______ cm(写出计算表达式)。
(1)原子轨道是指电子在原子核外的
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为
(4)下图是含元素Cu、S的有机物的结构简式:

①该有机化合物结构中含有的化学键类型是
②S原子的杂化方式为
(5)下图是Cu-Au合金的一种立方晶体结构:

已知该合金的密度分dg/cm3,阿伏伽德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为
您最近一年使用:0次
2018-04-20更新
|
299次组卷
|
2卷引用:河南省天一大联考2018届高三阶段性测试(五)(河南版) 理科综合化学试题
解答题-有机推断题
|
适中(0.65)
名校
12. 以芳香烃A和化合物F为原料合成除草剂双苯噁唑酸(I)的一种工艺流程如下:
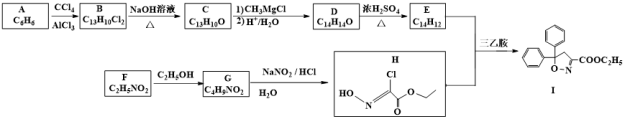
已知以下信息:
①B、C、D、E中均含有两个苯环。
②E能使Br2的CCl4溶液褪色,其核磁共振氢谱有4组峰,峰面积比为2:2:1:1;F中含有两种官能团且具有两性;G能发生水解反应。
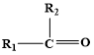
③ (不稳定)
(不稳定)
④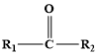

 ;RCl
;RCl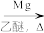 RMgCl
RMgCl
回答下列问题:
(1)F的化学名称为_______ 。
(2)A生成B、D生成E的反应类型依次为______________ 、___________________ 。
(3)E、G的结构简式依次为__________________ 、________________ 。
(4)B生成C的化学方程式为_________ 。
(5)芳香化合物X是D的同分异构体,X的苯环上有3个取代基,能与 溶液发生显色反应,能使
溶液发生显色反应,能使 的
的 溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写出两种符合要求的X的结构简式:
溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写出两种符合要求的X的结构简式:______________ 。
(6)根据题给信息,写出以乙醛为原料制备2-丁醇的合成路线:________ (其他试剂任用)。

已知以下信息:
①B、C、D、E中均含有两个苯环。
②E能使Br2的CCl4溶液褪色,其核磁共振氢谱有4组峰,峰面积比为2:2:1:1;F中含有两种官能团且具有两性;G能发生水解反应。
③
 (不稳定)
(不稳定)

④


 ;RCl
;RCl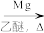 RMgCl
RMgCl回答下列问题:
(1)F的化学名称为
(2)A生成B、D生成E的反应类型依次为
(3)E、G的结构简式依次为
(4)B生成C的化学方程式为
(5)芳香化合物X是D的同分异构体,X的苯环上有3个取代基,能与
 溶液发生显色反应,能使
溶液发生显色反应,能使 的
的 溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写出两种符合要求的X的结构简式:
溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写出两种符合要求的X的结构简式:(6)根据题给信息,写出以乙醛为原料制备2-丁醇的合成路线:
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、有机化学基础、认识化学科学、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 合理安排饮食 大气污染的治理原理及方法 金属材料的性质及利用 | |
| 2 | 0.65 | 同分异构体的数目的确定 取代反应 乙酸乙酯制备实验的综合考查 | |
| 3 | 0.65 | 阿伏加德罗常数的应用 | |
| 4 | 0.65 | 硫酸根离子的检验 常见阴离子的检验 化学实验方案的设计与评价 | |
| 5 | 0.65 | 原电池原理 电解原理 | |
| 6 | 0.65 | 元素周期律、元素周期表的推断 | |
| 7 | 0.65 | 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐的水解常数 | |
| 二、解答题 | |||
| 8 | 0.4 | 铁的其他化合物 化学反应原理综合考查 物质分离、提纯综合应用 常见无机物的制备 | 实验探究题 |
| 9 | 0.65 | 盖斯定律的应用 化学反应速率计算 化学平衡常数的有关计算 原电池原理的应用 | 原理综合题 |
| 10 | 0.65 | 铜 化学实验探究 综合实验设计与评价 | 实验探究题 |
| 11 | 0.65 | 能层与能级 电离能变化规律 共价键的形成及主要类型 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 核磁共振氢谱 根据要求书写同分异构体 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |



