名校
解题方法
1 . 氨是一种重 要的化工原料,可用于制造铵态化肥。已知:N2(g)+3H2(g) 2NH3(g) ΔH=-91kJ/mol。回答下列问题:
2NH3(g) ΔH=-91kJ/mol。回答下列问题:
(1)已知上述反应的熵变(ΔS)为-198.9J·mol-1·K-1,该反应能自发进行的温度可能是___________(填标号)。
(2)在恒温恒容条件下,充入等物质的量的N2和H2合成氨气,下列情况表明该反应达到平衡状态的是___________(填标号)。
(3)在催化剂作用下,合成氨的反应速率为 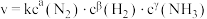 (k为速率常数,只与温度、催化剂有关,与浓度无关。a、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:
(k为速率常数,只与温度、催化剂有关,与浓度无关。a、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:
①α+β+γ=___________
②已知经验公式为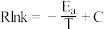 (其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度(
(其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度( )的关系如图1所示。
)的关系如图1所示。
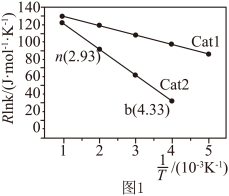
催化效率较高的是______ (填“Catl”或“Cat2”),在Cat2催化剂作用下。活化能Ea为 ___________
(4)在体积均为2L的甲、乙两恒容密闭容器中分别通入 l mol N2 和3mol H2,分别在不同条件下达到平衡,测得 NH₃的物质的量与时间的关系如图2所示。
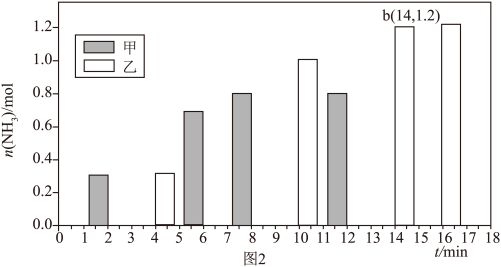
①相对甲,乙仅改变的一个条件是___________ ,正反应速率:a___________ (填“>”、“<”或“=”)b。
②在该条件下,乙的平衡常数为___________ (结果保留2位小数)。
 2NH3(g) ΔH=-91kJ/mol。回答下列问题:
2NH3(g) ΔH=-91kJ/mol。回答下列问题:(1)已知上述反应的熵变(ΔS)为-198.9J·mol-1·K-1,该反应能自发进行的温度可能是___________(填标号)。
| A.25 ℃ | B.150 ℃ | C.1273 ℃ | D.1457.5 ℃ |
| A.混合气体密度不随时间变化 | B.N₂ 体积分数不随时间变化 |
| C.混合气体总压强不随时间变化 | D.H2与 NH3的消耗速率之比为3∶2 |
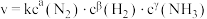 (k为速率常数,只与温度、催化剂有关,与浓度无关。a、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:
(k为速率常数,只与温度、催化剂有关,与浓度无关。a、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:| 序号 | c(N2)/(mol·L-1) | c(H2)/(mol·L-1) | c(NH3)/( mol·L-1) | 反应速率 |
| I | 1 | 1 | 1 | V |
| Ⅱ | 2 | 1 | 1 | 2v |
| Ⅲ | 1 | 4 | 1 | 16v |
| Ⅳ | 1 | 4 | 2 | 16v |
②已知经验公式为
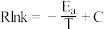 (其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度(
(其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度( )的关系如图1所示。
)的关系如图1所示。
催化效率较高的是
(4)在体积均为2L的甲、乙两恒容密闭容器中分别通入 l mol N

①相对甲,乙仅改变的一个条件是
②在该条件下,乙的平衡常数为
您最近一年使用:0次
2023-10-17更新
|
434次组卷
|
3卷引用:甘肃省白银市部分高中2024届高三上学期10月联考化学试题
解题方法
2 . 研究CO2资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。
(1)已知:
Ⅰ.
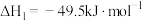
Ⅱ.
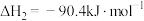
Ⅲ.

①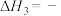
_______ 
②一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2,发生上述反应,达到平衡时,容器中CH3OH(g)的物质的量为0.5mol;CO的物质的量为0.3mol;此时H2O(g)的浓度为_______ mol·L-1。
(2)CO2在Cu—ZnO催化下,同时发生反应Ⅰ、Ⅲ;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2;起始及达到平衡时(t min时恰好达到平衡);容器内各气体物质的量及总压强如下表:
若反应Ⅰ、Ⅲ均达到平衡时,p0=1.4p;则表中n=_______ ;0~t min内,CO2的分压变化率为_______ kPa·min⁻¹;反应Ⅰ的平衡常数Kp=_______ (kPa)-2(用含p的式子表示)。
(3)CO2催化加氢制甲烷涉及的反应主要有:
主反应:
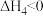
副反应:

若将CO2和H2按体积比为1∶4混合(n总=5mol);匀速通入装有催化剂的反应容器中,发生反应(包括主反应和副反应)。反应相同时间,CO2转化率、CH4和CO选择性随温度变化的曲线分别如图所示。
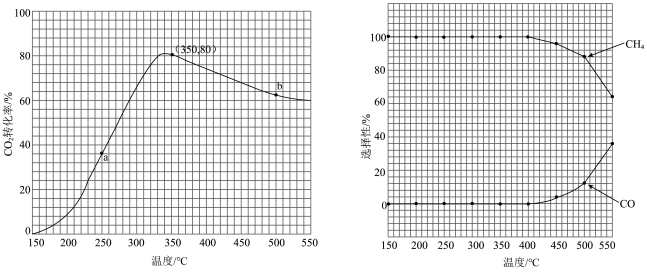
①a点的正反应速率和逆反应速率的大小关系为v正(a)_______ (填“>”、“=”或“<”)v逆(a)。
②催化剂在较低温度时主要选择_______ (填“主反应”或“副反应”)。
③350~400℃;CO2转化率呈现减小的变化趋势,其原因是_______ 。
(1)已知:
Ⅰ.

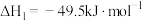
Ⅱ.

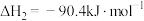
Ⅲ.


①
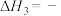

②一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2,发生上述反应,达到平衡时,容器中CH3OH(g)的物质的量为0.5mol;CO的物质的量为0.3mol;此时H2O(g)的浓度为
(2)CO2在Cu—ZnO催化下,同时发生反应Ⅰ、Ⅲ;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2;起始及达到平衡时(t min时恰好达到平衡);容器内各气体物质的量及总压强如下表:
| 物质的量/mol | 总压强/kPa | |||||
| CO2 | H2 | CH3OH(g) | CO | H2O(g) | ||
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 | p0 |
| 平衡 | n | 0.3 | p | |||
(3)CO2催化加氢制甲烷涉及的反应主要有:
主反应:

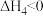
副反应:


若将CO2和H2按体积比为1∶4混合(n总=5mol);匀速通入装有催化剂的反应容器中,发生反应(包括主反应和副反应)。反应相同时间,CO2转化率、CH4和CO选择性随温度变化的曲线分别如图所示。

①a点的正反应速率和逆反应速率的大小关系为v正(a)
②催化剂在较低温度时主要选择
③350~400℃;CO2转化率呈现减小的变化趋势,其原因是
您最近一年使用:0次
2023-09-09更新
|
264次组卷
|
4卷引用:甘肃省白银市靖远县2024届高三上学期第一次联考化学试题
名校
3 . 一种Pt(包括 和
和 )@S-1(沸石骨架)催化剂为设计高活性、长周期稳定的甲醇水蒸气重整制氢提供了可行的策略,反应机理如图所示。下列说法错误的是
)@S-1(沸石骨架)催化剂为设计高活性、长周期稳定的甲醇水蒸气重整制氢提供了可行的策略,反应机理如图所示。下列说法错误的是

 和
和 )@S-1(沸石骨架)催化剂为设计高活性、长周期稳定的甲醇水蒸气重整制氢提供了可行的策略,反应机理如图所示。下列说法错误的是
)@S-1(沸石骨架)催化剂为设计高活性、长周期稳定的甲醇水蒸气重整制氢提供了可行的策略,反应机理如图所示。下列说法错误的是
| A.图中甲醇水蒸气重整制氢的过程中涉及极性键的断裂和形成 |
B.通过调节 和 和 的比例,可以调控CO和 的比例,可以调控CO和 的生成含量 的生成含量 |
C.在 和 和 的协同催化作用下,甲醇水蒸气重整制氢的速率提高 的协同催化作用下,甲醇水蒸气重整制氢的速率提高 |
D.在 的作用下, 的作用下, 发生的反应为 发生的反应为 |
您最近一年使用:0次
2023-06-29更新
|
214次组卷
|
2卷引用:甘肃省靖远县第一中学2022-2023学年高二下学期期末练习化学试题
名校
4 . 为消除燃煤烟气中含有的 、
、 ,研究者提出若干烟气“脱硫”“脱硝”的方法。
,研究者提出若干烟气“脱硫”“脱硝”的方法。
【方法一】以NaClO作为吸收剂进行一体化“脱硫”“脱硝”,将烟气中的 、NO转化为
、NO转化为 、
、 。
。
(1)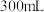

 溶液理论上最多能吸收标准状况下NO的体积为
溶液理论上最多能吸收标准状况下NO的体积为_______ L。
(2)实验室利用模拟烟气(模拟烟气中 和NO的物质的量之比为
和NO的物质的量之比为 )探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
)探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。

①此方法“脱硫”“脱硝”探究实验的最佳温度为_______ ; 的脱除率高于
的脱除率高于 ,其原因除
,其原因除 的还原性比
的还原性比 强外,还可能是
强外,还可能是_______ 。
② 时,吸收液中烟气转化生成的
时,吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为_______ 。
【方法二】 技术(选择性催化还原氮氧化物)
技术(选择性催化还原氮氧化物)
研究表明,铁基催化剂在260~300℃范围内实现 技术的过程如图所示。
技术的过程如图所示。
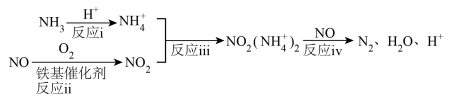
(3)根据上述机理, 在反应过程中的作用为
在反应过程中的作用为_______ ;等物质的量的 、
、 在有氧条件下转化为
在有氧条件下转化为 的总反应化学方程式为
的总反应化学方程式为_______ ;
(4)若使用锰基催化剂(活性物质为 )代替铁基催化剂,烟气中含有的
)代替铁基催化剂,烟气中含有的 会使催化剂失效而降低
会使催化剂失效而降低 脱除率,用化学方程式表示催化剂失效的原因:
脱除率,用化学方程式表示催化剂失效的原因:_______ 。
(5)向反应体系中添加 可显著提高
可显著提高 脱除率,原因是
脱除率,原因是 与
与 反应生成
反应生成 和阴离子M;阴离子M再与
和阴离子M;阴离子M再与 发生反应转化为
发生反应转化为 ,则阴离子M为
,则阴离子M为_______ 。
 、
、 ,研究者提出若干烟气“脱硫”“脱硝”的方法。
,研究者提出若干烟气“脱硫”“脱硝”的方法。【方法一】以NaClO作为吸收剂进行一体化“脱硫”“脱硝”,将烟气中的
 、NO转化为
、NO转化为 、
、 。
。(1)

 溶液理论上最多能吸收标准状况下NO的体积为
溶液理论上最多能吸收标准状况下NO的体积为(2)实验室利用模拟烟气(模拟烟气中
 和NO的物质的量之比为
和NO的物质的量之比为 )探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
)探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
①此方法“脱硫”“脱硝”探究实验的最佳温度为
 的脱除率高于
的脱除率高于 ,其原因除
,其原因除 的还原性比
的还原性比 强外,还可能是
强外,还可能是②
 时,吸收液中烟气转化生成的
时,吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为【方法二】
 技术(选择性催化还原氮氧化物)
技术(选择性催化还原氮氧化物)研究表明,铁基催化剂在260~300℃范围内实现
 技术的过程如图所示。
技术的过程如图所示。
(3)根据上述机理,
 在反应过程中的作用为
在反应过程中的作用为 、
、 在有氧条件下转化为
在有氧条件下转化为 的总反应化学方程式为
的总反应化学方程式为(4)若使用锰基催化剂(活性物质为
 )代替铁基催化剂,烟气中含有的
)代替铁基催化剂,烟气中含有的 会使催化剂失效而降低
会使催化剂失效而降低 脱除率,用化学方程式表示催化剂失效的原因:
脱除率,用化学方程式表示催化剂失效的原因:(5)向反应体系中添加
 可显著提高
可显著提高 脱除率,原因是
脱除率,原因是 与
与 反应生成
反应生成 和阴离子M;阴离子M再与
和阴离子M;阴离子M再与 发生反应转化为
发生反应转化为 ,则阴离子M为
,则阴离子M为
您最近一年使用:0次
2022-11-19更新
|
210次组卷
|
2卷引用:甘肃省永昌县第一高级中学2023-2024学年高三上学期期中考试化学试题
名校
5 . 用硫酸分解磷尾矿[主要成分为Ca5(PO4)3F]可制得中强酸磷酸。已知:25 ℃时,H3PO4的电离平衡常数:K1=7.1×10−3;K2=6.3×10−8;K3=4.2×10−13.请回答:
(1)NaH2PO4溶液中c(HP )
) ___________ c(H3PO4)(填“>”“<”或“=”)。
(2)25 ℃时,H2P (aq)+OH-(aq)
(aq)+OH-(aq)  HP
HP (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=___________ 。
(3)Ca5(PO4)3F(s)+OH-(aq) Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
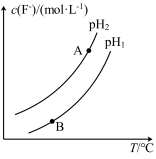
则:pH1___________ pH2(填“>”“<”或“=”,下同);A、B两点的溶液中用F-表示的反应速率υ(A)___________ υ(B)。
(4)下列说法正确的是___________
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中 的值增大
的值增大
D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
(1)NaH2PO4溶液中c(HP
 )
) (2)25 ℃时,H2P
 (aq)+OH-(aq)
(aq)+OH-(aq)  HP
HP (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=(3)Ca5(PO4)3F(s)+OH-(aq)
 Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH)(s)+F-(aq),溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
则:pH1
(4)下列说法正确的是
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中
 的值增大
的值增大D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
您最近一年使用:0次
2020-12-11更新
|
524次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题
名校
6 . 已知X和Y能发生如下反应:X+Y=H2O+盐,下列有关物质X和Y所属种类的判断中一定不正确的是( )
| A.X为酸、Y为碱 | B.X为碱性氧化物、Y为酸 |
| C.X为盐、Y为碱 | D.X为碱性氧化物、Y为酸性氧化物 |
您最近一年使用:0次
2018-09-12更新
|
1834次组卷
|
31卷引用:甘肃省部分学校2023-2024学年高一上学期10月期中考试化学试题
甘肃省部分学校2023-2024学年高一上学期10月期中考试化学试题甘肃省兰州市西固区三校2021-2022学年高一上学期期中联考化学试题甘肃省天水市第一中学2022-2023学年高一上学期第一学段检测化学试题(已下线)第二章 化学物质及其变化 第1讲 物质的变化及分类第2课时 物质的转化湖北省荆州市沙市中学2023-2024学年高一上学期9月月考化学试题河北省石家庄北华中学2023-2024学年高一上学期10月月考考试化学试题云南省峨山彝族自治县峨山一中2018-2019学年高二入学考试化学试题【全国百强校】山东省枣庄市第八中学东校区2019届高三9月月考化学试题贵州省毕节市织金县第一中学2018-2019学年高一上学期12月份考试化学试题鲁科版新教材(2019)化学同步2.1.1 元素与物质的关系 物质分类与物质性质福建省莆田市第六中学2019-2020学年高一上学期第一次月考化学试题(B)备战2020高考化学二轮专项训练:多角度考查物质变化云南省福贡县第一中学2019-2020学年高一上学期期末考试化学试题人教版高一化学必修1第二章《化学物质及其变化》测试卷(已下线)专题2.1 物质的分类 胶体 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)2.1.1 元素与物质的关系 物质分类与物质性质练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)专题01 物质的分类及转化(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学广东省深圳市第七高级中学2020-2021学年高一上学期第一学段考试化学试题(已下线)练习2 物质的转化-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)(已下线)衔接点02 酸碱盐的分类和命名-2021年初升高化学无忧衔接(已下线)课时03 物质的组成、分类和性质-2022年高考化学一轮复习小题多维练(全国通用)福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期中考试化学试题(已下线)衔接点03 酸碱盐的分类和命名-2022年初升高化学无忧衔接(已下线)第01练 物质的分类及转化-2023年高考化学一轮复习小题多维练(全国通用)广东省揭阳华侨高级中学2021-2022学年高一上学期第一次阶段考试化学试题黑龙江省哈尔滨市第一中学2021-2022学年高一上学期期中考试化学试题 广西钦州市第四中学2021-2022学年高一上学期期中考试化学试题吉林省长春外国语学校2022-2023学年高一上学期第一次月考化学试题山东省“学情空间”区域教研共同体2022-2023学年高一上学期10月联考(人教版)化学试题



