名校
1 . 减少 排放并实现
排放并实现 的有效转化是科研的热点。以下几种为常见的
的有效转化是科研的热点。以下几种为常见的 利用方法,回答下列问题:
利用方法,回答下列问题:
I.利用 干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.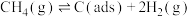
ii.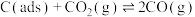 [
[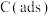 为吸附活性炭]
为吸附活性炭]
反应过程的能量变化如图所示:
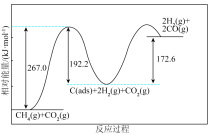
(1) 干重整反应的总热化学方程式为
干重整反应的总热化学方程式为___________ ,其反应速率由反应ⅰ决定,则反应ⅱ的逆反应活化能应小于___________  。
。
II.以氧化铟(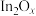 )作催化剂,可实现
)作催化剂,可实现 催化加氢制甲醇。
催化加氢制甲醇。
已知:①催化剂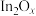 中
中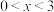 时具有活性,而
时具有活性,而 时无活性。
时无活性。
② 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
反应iii:主反应
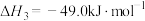
反应iv:副反应
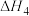
(2)工业上以原料气通过催化剂表面的方法生产甲醇, 是造成催化剂失活的重要原因,为了减少催化剂的失活,可以采用的方法是
是造成催化剂失活的重要原因,为了减少催化剂的失活,可以采用的方法是___________ 。
(3)反应iii、iv的平衡常数的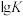 随
随 的变化曲线如图所示:
的变化曲线如图所示:

由图可知,代表反应iii的曲线是___________ (填“ ”或“
”或“ ”),原因是
”),原因是___________ ;升高温度,反应iv的平衡常数
___________ (填“增大”“减小”或“不变”)。
(4)在恒温恒容密闭容器中,按物质的量比 加入
加入 和
和 ,发生反应iii和反应iv,初始压强为
,发生反应iii和反应iv,初始压强为 。相同时间内
。相同时间内 的转化率、甲醇的产率在不同温度下的变化如图所示(不考虑温度对催化剂的影响):
的转化率、甲醇的产率在不同温度下的变化如图所示(不考虑温度对催化剂的影响):
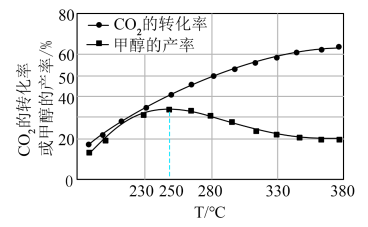
①在 以上,升高温度,甲醇的产率降低的原因是
以上,升高温度,甲醇的产率降低的原因是___________ 。
② 时,反应已处于平衡状态,此时容器内压强为
时,反应已处于平衡状态,此时容器内压强为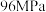 ,则反应ⅳ的平衡常数
,则反应ⅳ的平衡常数
___________ (结果用分数表示)。
 排放并实现
排放并实现 的有效转化是科研的热点。以下几种为常见的
的有效转化是科研的热点。以下几种为常见的 利用方法,回答下列问题:
利用方法,回答下列问题:I.利用
 干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:i.
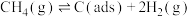
ii.
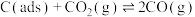 [
[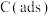 为吸附活性炭]
为吸附活性炭]反应过程的能量变化如图所示:

(1)
 干重整反应的总热化学方程式为
干重整反应的总热化学方程式为 。
。II.以氧化铟(
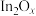 )作催化剂,可实现
)作催化剂,可实现 催化加氢制甲醇。
催化加氢制甲醇。已知:①催化剂
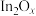 中
中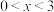 时具有活性,而
时具有活性,而 时无活性。
时无活性。②
 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:反应iii:主反应

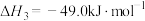
反应iv:副反应

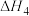
(2)工业上以原料气通过催化剂表面的方法生产甲醇,
 是造成催化剂失活的重要原因,为了减少催化剂的失活,可以采用的方法是
是造成催化剂失活的重要原因,为了减少催化剂的失活,可以采用的方法是(3)反应iii、iv的平衡常数的
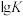 随
随 的变化曲线如图所示:
的变化曲线如图所示:
由图可知,代表反应iii的曲线是
 ”或“
”或“ ”),原因是
”),原因是
(4)在恒温恒容密闭容器中,按物质的量比
 加入
加入 和
和 ,发生反应iii和反应iv,初始压强为
,发生反应iii和反应iv,初始压强为 。相同时间内
。相同时间内 的转化率、甲醇的产率在不同温度下的变化如图所示(不考虑温度对催化剂的影响):
的转化率、甲醇的产率在不同温度下的变化如图所示(不考虑温度对催化剂的影响):
①在
 以上,升高温度,甲醇的产率降低的原因是
以上,升高温度,甲醇的产率降低的原因是②
 时,反应已处于平衡状态,此时容器内压强为
时,反应已处于平衡状态,此时容器内压强为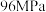 ,则反应ⅳ的平衡常数
,则反应ⅳ的平衡常数
您最近一年使用:0次
2024-02-08更新
|
406次组卷
|
3卷引用:山西省大同市教育局2023-2024学年高三上学期冬季检测化学试卷
名校
解题方法
2 . 氨的合成对国民经济发展有重要意义,Haber-Bosch法合成氨发生的反应为: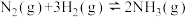 ,回答下列问题:
,回答下列问题:
(1)氨气可用于工业脱硝(NO),脱硝反应为:

已知:反应①: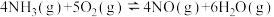

反应②:

反应①中正反应的活化能___________ 逆反应的活化能(填“小于”或“大于”),由反应①和反应②可知脱硝反应的
___________  。
。
(2)在密闭容器中充入0.1 mol 和0.3 mol
和0.3 mol  模拟Haber-Bosch法合成氨,平衡时
模拟Haber-Bosch法合成氨,平衡时 的体积分数(ω)随温度和压强(单位:kPa)的变化如图所示。
的体积分数(ω)随温度和压强(单位:kPa)的变化如图所示。

①图中压强从大到小的顺序是___________ (压强用 、
、 、
、 表示),写出判断依据:
表示),写出判断依据:___________ 。
②250℃,压强为 条件下,10 min反应达到平衡,若平衡时容器体积为2 L,则0~10 min内氨气的平均反应速率为
条件下,10 min反应达到平衡,若平衡时容器体积为2 L,则0~10 min内氨气的平均反应速率为___________  。
。
③250℃,压强为 条件下反应
条件下反应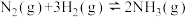 的压强平衡常数
的压强平衡常数
___________  (用气体的平衡分压代替平衡浓度计算,某气体的平衡分压=平衡时气体总压×该气体的物质的量分数,结果保留1位小数)。图中
(用气体的平衡分压代替平衡浓度计算,某气体的平衡分压=平衡时气体总压×该气体的物质的量分数,结果保留1位小数)。图中 (A点)
(A点)___________  (B点)(填“>”“<”或“=”)。
(B点)(填“>”“<”或“=”)。
④不改变 、
、 的初始投入量和催化剂的种类,为了提高
的初始投入量和催化剂的种类,为了提高 的产率,除了改变温度和压强外还可采取的措施是
的产率,除了改变温度和压强外还可采取的措施是___________ 。
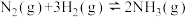 ,回答下列问题:
,回答下列问题:(1)氨气可用于工业脱硝(NO),脱硝反应为:


已知:反应①:
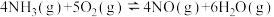

反应②:


反应①中正反应的活化能

 。
。(2)在密闭容器中充入0.1 mol
 和0.3 mol
和0.3 mol  模拟Haber-Bosch法合成氨,平衡时
模拟Haber-Bosch法合成氨,平衡时 的体积分数(ω)随温度和压强(单位:kPa)的变化如图所示。
的体积分数(ω)随温度和压强(单位:kPa)的变化如图所示。
①图中压强从大到小的顺序是
 、
、 、
、 表示),写出判断依据:
表示),写出判断依据:②250℃,压强为
 条件下,10 min反应达到平衡,若平衡时容器体积为2 L,则0~10 min内氨气的平均反应速率为
条件下,10 min反应达到平衡,若平衡时容器体积为2 L,则0~10 min内氨气的平均反应速率为 。
。③250℃,压强为
 条件下反应
条件下反应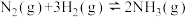 的压强平衡常数
的压强平衡常数
 (用气体的平衡分压代替平衡浓度计算,某气体的平衡分压=平衡时气体总压×该气体的物质的量分数,结果保留1位小数)。图中
(用气体的平衡分压代替平衡浓度计算,某气体的平衡分压=平衡时气体总压×该气体的物质的量分数,结果保留1位小数)。图中 (A点)
(A点) (B点)(填“>”“<”或“=”)。
(B点)(填“>”“<”或“=”)。④不改变
 、
、 的初始投入量和催化剂的种类,为了提高
的初始投入量和催化剂的种类,为了提高 的产率,除了改变温度和压强外还可采取的措施是
的产率,除了改变温度和压强外还可采取的措施是
您最近一年使用:0次
2023-10-14更新
|
280次组卷
|
2卷引用:山西省朔州市怀仁市第一中学校2023-2024学年高二上学期11月月考化学试题
解题方法
3 . 完成下列问题
(1)科学家通过电化学方法实现了二氧化碳的捕捉并将其转化成高值燃料甲烷,其发生的化学反应主要为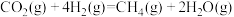 。已知断裂1mol化学键需要吸收的能量如下表所示:
。已知断裂1mol化学键需要吸收的能量如下表所示:
则该反应为___________ 反应(填“放热”或“吸热”),每消耗1molCO2吸收或放出热量为___________ kJ。
(2)工业上可用反应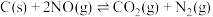 处理含氮废气,在某容积为2L的密闭容器内加入2molC和2molNO,在一定条件下发生反应,5min时测得C的质量为18g。
处理含氮废气,在某容积为2L的密闭容器内加入2molC和2molNO,在一定条件下发生反应,5min时测得C的质量为18g。
①该段时间内用N2表示的平均反应速率为___________ ;
②若5min时反应达到平衡,此时容器内气体密度与反应开始时气体密度之比为___________ ;
③下列事实能说明该反应已达平衡状态的是___________ (填标号);
A.消耗12gC同时消耗44gCO2
B.C的质量不再变化
C.容器内压强不再变化
D.容器内气体密度不再变化
E.容器内气体平均相对分子质量不再变化
F.每有1molC=O键生成,同时有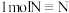 键断裂
键断裂
④改变下列条件能加快该反应速率的是___________ (填标号)。
A.压缩容器体积B.再加入12gC
C.通入NOD.向容器内滴加1mL稀NaOH溶液
(1)科学家通过电化学方法实现了二氧化碳的捕捉并将其转化成高值燃料甲烷,其发生的化学反应主要为
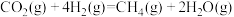 。已知断裂1mol化学键需要吸收的能量如下表所示:
。已知断裂1mol化学键需要吸收的能量如下表所示:| 化学键 | C=O | H-H | C-H | H-O |
| 吸收能量(kJ/mol) | 728 | 436 | 414 | 464 |
(2)工业上可用反应
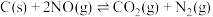 处理含氮废气,在某容积为2L的密闭容器内加入2molC和2molNO,在一定条件下发生反应,5min时测得C的质量为18g。
处理含氮废气,在某容积为2L的密闭容器内加入2molC和2molNO,在一定条件下发生反应,5min时测得C的质量为18g。①该段时间内用N2表示的平均反应速率为
②若5min时反应达到平衡,此时容器内气体密度与反应开始时气体密度之比为
③下列事实能说明该反应已达平衡状态的是
A.消耗12gC同时消耗44gCO2
B.C的质量不再变化
C.容器内压强不再变化
D.容器内气体密度不再变化
E.容器内气体平均相对分子质量不再变化
F.每有1molC=O键生成,同时有
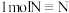 键断裂
键断裂④改变下列条件能加快该反应速率的是
A.压缩容器体积B.再加入12gC
C.通入NOD.向容器内滴加1mL稀NaOH溶液
您最近一年使用:0次
名校
4 . 某温度下,在2L恒容的密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。据图回答:
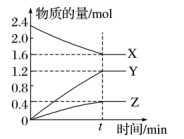
(1)该反应的化学方程式可表示为___________ 。
(2)反应起始至t min(设t=5),X的平均反应速率是___________ 。
(3)在t min时,该反应达到了_______ 状态,下列可判断反应已达到该状态的是________ (填字母,下同)。
A.X、Y、Z的反应速率相等B.X、Y的反应速率比为2∶3
C.混合气体的密度不变D.生成1mol Z的同时生成2mol X
(4)从开始到t秒末X的转化率______ (写成百分数,保留一位小数)。
(5)一定能使该反应的反应速率增大的措施有________。
(6)在一个体积固定的密闭容器中,进行的可逆反应 。下列叙述中表明可逆反应一定达到平衡状态的是
。下列叙述中表明可逆反应一定达到平衡状态的是_______ (填序号)
①C的生成速率与C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③B的浓度不再变化;
④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1∶3∶3;
⑥混合气体的密度不再变化;
⑦混合气体的平均摩尔质量不再发生变化

(1)该反应的化学方程式可表示为
(2)反应起始至t min(设t=5),X的平均反应速率是
(3)在t min时,该反应达到了
A.X、Y、Z的反应速率相等B.X、Y的反应速率比为2∶3
C.混合气体的密度不变D.生成1mol Z的同时生成2mol X
(4)从开始到t秒末X的转化率
(5)一定能使该反应的反应速率增大的措施有________。
| A.其他条件不变,及时分离出产物 |
| B.适当降低温度 |
| C.其他条件不变,增大X的浓度 |
| D.保持体积不变,充入Ar气使容器内压强增大 |
 。下列叙述中表明可逆反应一定达到平衡状态的是
。下列叙述中表明可逆反应一定达到平衡状态的是①C的生成速率与C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③B的浓度不再变化;
④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1∶3∶3;
⑥混合气体的密度不再变化;
⑦混合气体的平均摩尔质量不再发生变化
您最近一年使用:0次
2023-04-14更新
|
583次组卷
|
2卷引用:山西省怀仁市第一中学校2022-2023学年高一下学期第二次月考(期中)化学试题
名校
5 . 用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)  N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式:_______ 。
(2)在2 L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
①结合表中数据,判断该反应的ΔH_______ (填“>”或“<”)0,理由是_______ 。
②判断该反应达到平衡状态的依据是_______ (填字母)。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
(3)700 ℃时,若向2 L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。请回答下列问题。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。请回答下列问题。

①0~10 min内CO2的平均反应速率v=_______ 。
②图中A点v正_______ (填“>”“<”或“=”)v逆。
③第10 min时,外界改变的条件可能是_______ (填字母)。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
(4)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。

容易得到的副产物有CO和CH2O,其中相对较多的副产物为_______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A.*CO+*OH *CO+*H2O B.*CO
*CO+*H2O B.*CO *OCH
*OCH
C.*OCH2 *OCH3 D.*OCH3
*OCH3 D.*OCH3 *CH3OH
*CH3OH
 N2(g)+CO2(g)。
N2(g)+CO2(g)。(1)写出上述反应的平衡常数表达式:
(2)在2 L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
| 实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.40 | 0.09 |
| 2 | 800 | 0.24 | 0.08 |
②判断该反应达到平衡状态的依据是
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
(3)700 ℃时,若向2 L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。请回答下列问题。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。请回答下列问题。
①0~10 min内CO2的平均反应速率v=
②图中A点v正
③第10 min时,外界改变的条件可能是
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
(4)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。

容易得到的副产物有CO和CH2O,其中相对较多的副产物为
A.*CO+*OH
 *CO+*H2O B.*CO
*CO+*H2O B.*CO *OCH
*OCHC.*OCH2
 *OCH3 D.*OCH3
*OCH3 D.*OCH3 *CH3OH
*CH3OH
您最近一年使用:0次
2023-03-05更新
|
250次组卷
|
3卷引用:山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题
2022·江苏南通·模拟预测
名校
解题方法
6 . 有效去除烟气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)O3能将NO和NO2转化成绿色硝化剂N2O5。已知下列热化学方程式:
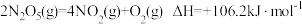
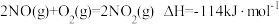

则反应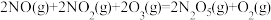 的
的
_______ 。
(2)一种通过 和
和 的相互转化脱除
的相互转化脱除 的原理如图1所示。脱除
的原理如图1所示。脱除 的总反应为
的总反应为_______ 。
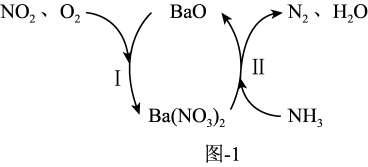
(3)NH3在催化剂作用下能与烟气(主要为空气,含少量NOx)中的NOx反应,实现NOx的脱除。常见的催化剂有V2O5等。反应的催化剂附在载体的表面,该载体为Ti的氧化物,其有两种晶体类型,分别如图2(a)、(b)所示,其中晶体a比表面积大,附着能力强,可用作载体,一定温度下可转化为晶体b。在V2O5催化下,NOx的脱除机理如图3所示。
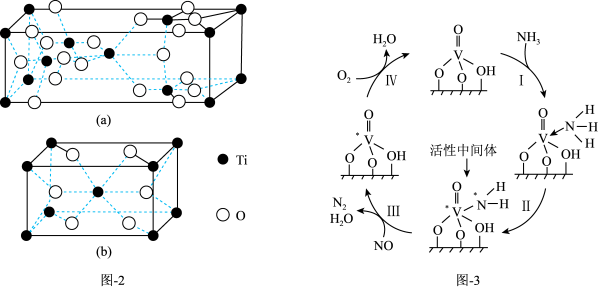
①晶体b的化学式为_______ 。
②转化IV中,V元素化合价的变化为_______ 。
③脱除NOx时须控制反应的温度,实验发现,其他条件一定,当温度过高时,NOx的脱除率会降低,原因除高温下不利于NH3的吸附、催化剂本身活性降低外,还可能的原因是_______ 和_______ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)O3能将NO和NO2转化成绿色硝化剂N2O5。已知下列热化学方程式:
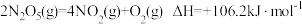
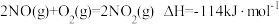

则反应
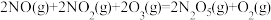 的
的
(2)一种通过
 和
和 的相互转化脱除
的相互转化脱除 的原理如图1所示。脱除
的原理如图1所示。脱除 的总反应为
的总反应为
(3)NH3在催化剂作用下能与烟气(主要为空气,含少量NOx)中的NOx反应,实现NOx的脱除。常见的催化剂有V2O5等。反应的催化剂附在载体的表面,该载体为Ti的氧化物,其有两种晶体类型,分别如图2(a)、(b)所示,其中晶体a比表面积大,附着能力强,可用作载体,一定温度下可转化为晶体b。在V2O5催化下,NOx的脱除机理如图3所示。

①晶体b的化学式为
②转化IV中,V元素化合价的变化为
③脱除NOx时须控制反应的温度,实验发现,其他条件一定,当温度过高时,NOx的脱除率会降低,原因除高温下不利于NH3的吸附、催化剂本身活性降低外,还可能的原因是
您最近一年使用:0次
2022-04-21更新
|
953次组卷
|
6卷引用:山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题
山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)江苏省南通市如皋市2021-2022学年高三下学期 4月适应性考试(二)化学试题(已下线)化学-2022年高考押题预测卷02(江苏卷)江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题(已下线)2022年江苏卷高考真题变式题14-17河南省周口恒大中学2023-2024学年高二下学期3月月考化学试题



