解题方法
1 . 从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________ (填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________ 。

(3)从断键和成键的角度分析上述反应中能量的变化。
请填写下表:
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______ 极发生_______ 反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______ L。
(1)为了加快正反应速率,可以采取的措施有
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是

(3)从断键和成键的角度分析上述反应中能量的变化。
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
请填写下表:
| 化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
| 拆开化学键 | 2molH2化学键 | ||
| 1molO2化学键 | |||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在
您最近一年使用:0次
2018-07-27更新
|
198次组卷
|
3卷引用:山西省柳林县2019-2020学年高一下学期期末教学质量检测化学试题
名校
2 . 研究NO2、NO、CO、NO2-等污染物的处理,对环境保护有重要的意义。
(1)①NO2(g)+CO(g) CO2(g)+NO(g) △H1=-234.00kJ·mol-1
CO2(g)+NO(g) △H1=-234.00kJ·mol-1
②1/2N2(g)+1/2O2(g) NO(g) △H2=-89.75 kJ·mol-1
NO(g) △H2=-89.75 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) △H3=-112.30kJ·mol-1
2NO2(g) △H3=-112.30kJ·mol-1
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为__________________ 。
(2)某温度下,向10L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生反应:2NO2(g)+ 4CO(g) N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
①0~10min内,CO的平均反应速率v(CO)=___________ ;
②若容器中观察到____________________________ ,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为
________ ;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡________ (填“右移”或“左移”或“不移动”)。
(3)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是________ [用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。


②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因_____________________________________ (假设该温度范围内催化剂的催化效率相同)。
(4)有人设想在含有NO2-的酸性污水中加入填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_________________________________ 。
(1)①NO2(g)+CO(g)
 CO2(g)+NO(g) △H1=-234.00kJ·mol-1
CO2(g)+NO(g) △H1=-234.00kJ·mol-1②1/2N2(g)+1/2O2(g)
 NO(g) △H2=-89.75 kJ·mol-1
NO(g) △H2=-89.75 kJ·mol-1③2NO(g)+O2(g)
 2NO2(g) △H3=-112.30kJ·mol-1
2NO2(g) △H3=-112.30kJ·mol-1若NO2气体和CO气体反应生成无污染气体,其热化学方程式为
(2)某温度下,向10L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生反应:2NO2(g)+ 4CO(g)
 N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30
N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的29/30①0~10min内,CO的平均反应速率v(CO)=
②若容器中观察到
③为增大污染物处理效率,起始最佳投料比为

④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡
(3)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是


②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因
(4)有人设想在含有NO2-的酸性污水中加入填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用
您最近一年使用:0次
2018-05-16更新
|
895次组卷
|
5卷引用:【市级联考】山西省吕梁市2019届高三上学期期末考试模拟化学试题
名校
3 . pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是


| A.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) |
| B.25℃时,H2CO3的一级电离平衡常数Ka1= 10-6 |
| C.25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1% |
| D.25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
您最近一年使用:0次
2018-03-27更新
|
1064次组卷
|
7卷引用:山西省吕梁市2018届高三上学期第一次模拟考试化学试题
山西省吕梁市2018届高三上学期第一次模拟考试化学试题山东省新泰市第一中学2019届高三上学期第二次质量检测化学试题【市级联考】安徽省黄山市2018-2019学年高二上学期期末考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——电解质溶液中的曲线问题(提升练习)(已下线)本册综合检测(一)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)2022年湖北省高考真题变式题11-15
解题方法
4 . 新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述正确的是
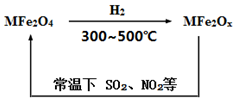

| A.MFe2O4表现了还原性 |
| B.若MFe2Ox与H2发生反应的物质的量之比为2∶1,则x=3.5 |
| C.在该反应中每有1molNO2的废气被处理将转移电子数4NA个 |
| D.SO2的还原性大于MFe2Ox |
您最近一年使用:0次
5 . 25℃时,某浓度的碳酸中含碳微粒的物质的量浓度的对数值与溶液的pH的关系如下图所示。下列说法正确的是
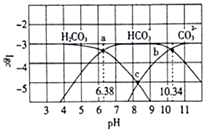

| A.lgKa1(H2CO3)=6.38 |
| B.C点对应溶液的pH=8.36 |
| C.溶液的pH=8时,c(HCO3-)>c(OH-)>c(CO32-) |
| D.25℃时,反应CO32-+H2CO3=2HCO3-的平衡常数对数值1gK=-6.96 |
您最近一年使用:0次
名校
6 . 下列现象或操作不适宜用勒夏特列原理解释的是
| A.合成氨时将氨液化分离可提高原料的利用率 |
| B.H2、I2、HI 混合气体加压后颜色变深 |
| C.新制氯水久置后颜色变浅 |
| D.锅炉水垢中含有 CaSO4,常先加 Na2CO3 再加酸处理 |
您最近一年使用:0次
2017-12-05更新
|
325次组卷
|
5卷引用:山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题
山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题湖南省宁远县第一中学等三校2017-2018学年高二上学期期中联考化学试题河南省鹤壁市淇县第一中学2018-2019学年高二上学期第三次月考化学试题山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)
解题方法
7 . 工业上合成氨的原理如下:N2(g)+3H2(g) 2NH3(g)△H。
2NH3(g)△H。
(1)已知H-H键的键能为436 kJ•mol-1,N-H键的键能为391kJ•mol-1,N=N键的键能是945.6 kJ•mol-1,则上述反应的△H=________ 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol•L-1• min-1;乙:v(N2)=2 mol•L-1• min-1;丙:v(H2)=4.5mol•L-1• min-1;丁:v(NH3)=0.075 mol•L-1• min-1。若其他条件相同,温度不同,则温度由高到低的顺序是______________ (填序号)。
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=________ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(4)在773 K时,分别将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
①图中表示c(N2)-t的曲线是________ 。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正________ v逆(填“>”“<”或“=”)。
 2NH3(g)△H。
2NH3(g)△H。(1)已知H-H键的键能为436 kJ•mol-1,N-H键的键能为391kJ•mol-1,N=N键的键能是945.6 kJ•mol-1,则上述反应的△H=
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol•L-1• min-1;乙:v(N2)=2 mol•L-1• min-1;丙:v(H2)=4.5mol•L-1• min-1;丁:v(NH3)=0.075 mol•L-1• min-1。若其他条件相同,温度不同,则温度由高到低的顺序是
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=
(4)在773 K时,分别将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
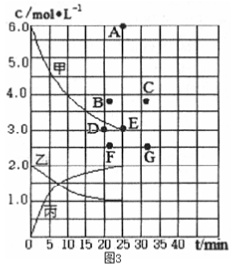
①图中表示c(N2)-t的曲线是
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正
您最近一年使用:0次
2017-11-03更新
|
116次组卷
|
2卷引用:山西省孝义市实验中学2017-2018学年高二上学期第二次月考化学试题
名校
8 . 已知NO和O2转化为NO2的反应机理如下:

①2NO(g) N2O2(g)(快)△H1<0,平衡常数K1
N2O2(g)(快)△H1<0,平衡常数K1
②N2O2(g)+O2(g) 2NO2(g)(慢) △H2<0,平衡常数K2
2NO2(g)(慢) △H2<0,平衡常数K2
下列说法正确的是

①2NO(g)
 N2O2(g)(快)△H1<0,平衡常数K1
N2O2(g)(快)△H1<0,平衡常数K1②N2O2(g)+O2(g)
 2NO2(g)(慢) △H2<0,平衡常数K2
2NO2(g)(慢) △H2<0,平衡常数K2下列说法正确的是
A.2NO(g)+O2(g) 2NO2(g)的△H=△H1+△H2 2NO2(g)的△H=△H1+△H2 |
B.2NO(g)+O2(g) 2NO2(g)的平衡常数K= K1/K2 2NO2(g)的平衡常数K= K1/K2 |
C.反应①的速率大小决定2NO(g)+O2(g) 2NO2(g)的反应速率 2NO2(g)的反应速率 |
| D.反应过程中的能量变化可用图a表示 |
您最近一年使用:0次
2017-10-15更新
|
603次组卷
|
8卷引用:山西省吕梁市2018届高三上学期第一次阶段性测试化学试题
14-15高三上·河北石家庄·阶段练习
名校
9 . 下列图示与对应的叙述相符的是
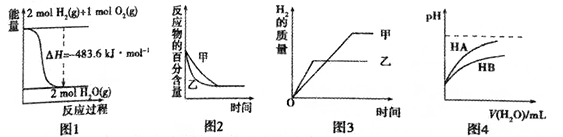

| A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol-1 |
B.图2表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.若图3表示等质量的钾、钠分别与足量水反应,则甲代表钠 |
| D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH |
您最近一年使用:0次
2016-12-09更新
|
1332次组卷
|
13卷引用:山西省孝义市2017届高三下学期考前热身训练理综化学试题
山西省孝义市2017届高三下学期考前热身训练理综化学试题(已下线)2015届河北省正定中学高三上学期第三次月考化学试卷山西省三区八校2017届高三第二次模拟考试理科综合化学试题【全国百强校】江苏省启东市启东中学2019届高三上学期第一次月考化学试题陕西省西安市长安区第五中学2019届高三上学期期中考试化学试题河北省衡水市衡水中学2019届高三上学期期中考试化学试题河南省南阳市2018届高三上学期期末考试理综化学试题【市级联考】江西省宜春市2019届高三上学期期末统考理科综合化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题福建省漳州市龙海市第二中学2020届高三上学期第二次月考化学试题甘肃省天水市一中2020届高三上学期第四次考试化学试题辽宁省辽河油田第二高级中学2020届高三期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——盐类水解平衡的影响因素及探究



