名校
1 . 我国学者研究了均相 NO- CO 的反应历程,反应路径中每一阶段内各驻点的能最均为相对于此阶段内反应物能量的能量之差,下列说法正确的是
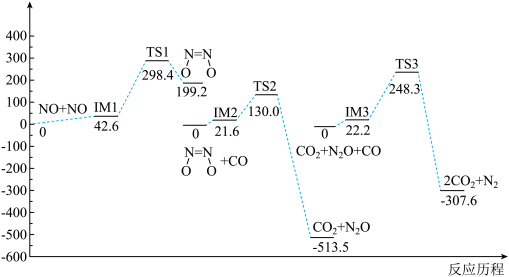

A.2NO(g)+ 2CO(g)  N2(g) +2CO2(g) ΔH>O N2(g) +2CO2(g) ΔH>O |
| B.均相NO—CO反应经历了三个过渡态和六个中间体 |
| C.整个反应分为三个基元反应阶段,总反应速率由第一阶段反应决定 |
D.NO二聚体(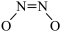 )比N2O分子更难与CO发生反应 )比N2O分子更难与CO发生反应 |
您最近一年使用:0次
名校
解题方法
2 . 已知反应S2O (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )

①2Fe3+(aq)+2I-(aq) I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)
②2Fe2+(aq)+S2O (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)
 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
①2Fe3+(aq)+2I-(aq)
 I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O
 (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)| A.Fe3+是该反应的催化剂,加入Fe3+后降低了该反应的活化能 |
| B.反应①比反应②所需活化能大 |
| C.向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深 |
| D.该反应可设计成原电池 |
您最近一年使用:0次
2020-09-25更新
|
1729次组卷
|
14卷引用:山西省大同市2021届高三上学期学情调研测试化学试题
山西省大同市2021届高三上学期学情调研测试化学试题辽宁省六校协作体2021届高三第一次联考化学试题江西省赣州市会昌县七校2021届高三联合9月月考化学试题辽宁省开原市中固镇第二中学2021届高三上学期9月月考化学试题内蒙古自治区赤峰二中2020-2021学年高二上学期第一次月考化学试题江西省红色七校(分宜中学、会昌中学、莲花中学、南城一中、任弼时中学、瑞金一中、遂川中学)2021届高三上学期第一次联考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题江苏省苏州市姑苏区苏州中学2020-2021学年高二下学期期中考试化学试题江西省景德镇一中2020-2021学年高一下学期期中考试化学(1班)试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题
名校
3 . 戴口罩是防控新型冠状病毒的重要手段,口罩生产的主要原料聚丙烯由丙烯聚合而来。丙烷脱氢是丙烯工业生产的重要途径。反应的热化学方程式为C3H8(g) C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:
(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是___ 。
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是___ 、___ 。
②丙烷脱氢制丙烯反应在___ (选“高温”或“低温”)时更加容易自发进行。
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是___ 。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为___ 。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___ 。
 C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是
②丙烷脱氢制丙烯反应在
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近一年使用:0次
2020-08-28更新
|
542次组卷
|
5卷引用:山西省大同市第一中学2021届高三上学期期中质量检测化学试题
山西省大同市第一中学2021届高三上学期期中质量检测化学试题河南省洛阳市2020届高三第三次统一考试理综化学试题(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编河南省洛阳市2020届高三三模化学试卷江西省吉安一中2021-2022学年高二上学期第一次段考化学试题
4 . 聚乙烯醇具有亲水性和成膜性,在适宜的浓度下,能起类似人工泪液的作用,作为润滑剂预防或治疗眼部刺激症状。聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l) CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)“洗衣凝珠”是由一层薄膜包裹洗衣液制成的新型洗涤产品,该薄膜的主要化学成分是可溶于水的聚乙烯醇(简称PVA)塑料,聚乙烯醇的化学式为(C2H4O)n,试回答:聚乙烯醇属于_____ (填“金属材料”、“有机合成材料”、“硅酸盐材料”、“复合材料”之一),从物质结构的角度解释聚乙烯醇具有亲水性的原因___________________________ 。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____ 时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___ (填增大、减小或不变)。
(3)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____ (保留2位有效数字)。A、B、C、D四点中,v逆最大的是___ ,v正最大的是____ 。
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____ 。
a.参与了醇解反应,但并不改变反应历程 b.提高乙酸甲酯的平衡转化率
c.提高了醇解反应的活化能 d.使k正和k逆增大相同倍数
 CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。(1)“洗衣凝珠”是由一层薄膜包裹洗衣液制成的新型洗涤产品,该薄膜的主要化学成分是可溶于水的聚乙烯醇(简称PVA)塑料,聚乙烯醇的化学式为(C2H4O)n,试回答:聚乙烯醇属于
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比
(3)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是
a.参与了醇解反应,但并不改变反应历程 b.提高乙酸甲酯的平衡转化率
c.提高了醇解反应的活化能 d.使k正和k逆增大相同倍数
您最近一年使用:0次
解题方法
5 . 氢气既是一种清洁能源,又是一种化工原料,在国民经济中发挥着重要的作用。
(1)氢气是制备二甲醚的原料之一,可通过以下途径制取:
Ⅰ.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H
Ⅱ.2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) △H
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=akJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=bkJ•mol-1
③CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H3=ckJ•mol-1
则反应Ⅱ的△H____ kJ•mol-1
(2)氢气也可以和CO2在催化剂(如Cu/ZnO)作用下直接生成CH3OH,方程式如下CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),现将1molCO2(g)和3molH2(g)充入2L刚性容器中发生反应,相同时间段内测得CH3OH的体积分数φ (CH3OH)与温度(T)的关系如图所示:
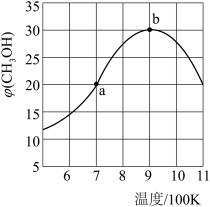
①经过10min达到a点,此时CH3OH的体积分数为20%.则v(H2)=___ (保留三位小数)。
②b点时,CH3OH的体积分数最大的原因是___ 。
③b点时,容器内平衡压强为 P0,CH3OH的体积分数为30%,则反应的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×体积分数)
④a点和b点的v逆,a__ b(填“>”“<”或”=”)若在900K时,向此刚性容器中再充入等物质的量的CH3OH和H2O,达平衡后φ(CH3OH)___ 30%。
⑤在900K及以后,下列措施能提高甲醇产率的是____ (填字母)
a.充入氦气 b.分离出H2O c.升温 d.改变催化剂
(3)H2还可以还原NO消除污染,反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(g),该反应速率表达式v=k•c2(NO)•c(H2)(k是速率常数,只与温度有关),上述反应分两步进行:
i.2NO(g)+H2(g)⇌N2(g)+H2O2(g)△H1;ii.H2O2(g)+H2(g)⇌2H2O(g)△H2化学总反应分多步进行,反应较慢的一步控制总反应速率,上述两步反应中,正反应的活化能较低的是___ (填“i”或“ii”)
(1)氢气是制备二甲醚的原料之一,可通过以下途径制取:
Ⅰ.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H
Ⅱ.2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) △H
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=akJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=bkJ•mol-1
③CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H3=ckJ•mol-1
则反应Ⅱ的△H
(2)氢气也可以和CO2在催化剂(如Cu/ZnO)作用下直接生成CH3OH,方程式如下CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),现将1molCO2(g)和3molH2(g)充入2L刚性容器中发生反应,相同时间段内测得CH3OH的体积分数φ (CH3OH)与温度(T)的关系如图所示:

①经过10min达到a点,此时CH3OH的体积分数为20%.则v(H2)=
②b点时,CH3OH的体积分数最大的原因是
③b点时,容器内平衡压强为 P0,CH3OH的体积分数为30%,则反应的平衡常数Kp=
④a点和b点的v逆,a
⑤在900K及以后,下列措施能提高甲醇产率的是
a.充入氦气 b.分离出H2O c.升温 d.改变催化剂
(3)H2还可以还原NO消除污染,反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(g),该反应速率表达式v=k•c2(NO)•c(H2)(k是速率常数,只与温度有关),上述反应分两步进行:
i.2NO(g)+H2(g)⇌N2(g)+H2O2(g)△H1;ii.H2O2(g)+H2(g)⇌2H2O(g)△H2化学总反应分多步进行,反应较慢的一步控制总反应速率,上述两步反应中,正反应的活化能较低的是
您最近一年使用:0次
2019-10-23更新
|
345次组卷
|
2卷引用:山西省大同十九中2020届高三(3月)线上高考模拟理综化学试题
名校
6 . 下列反应不可用于设计原电池的是
| A.2CH3OH+3O2=2CO2+4H2O | B.Ba2++SO42-=BaSO4↓ |
| C.Zn+2HCl=ZnCl2+H2↑ | D.4Al+3O2+6H2O=4Al(OH)3 |
您最近一年使用:0次
2019-06-13更新
|
311次组卷
|
3卷引用:山西省大同市第一中学2019-2020学年高一下学期5月网上考试化学试题
名校
7 . 下列反应中的能量变化如图所示的是


| A.Al与盐酸的反应 |
| B.Na与H2O的反应 |
| C.NaOH与盐酸的反应 |
| D.Ba(OH)2·8H2O与NH4Cl的反应 |
您最近一年使用:0次
2019-06-13更新
|
160次组卷
|
3卷引用:山西省大同市第一中学2019-2020学年高一下学期5月网上考试化学试题
8 . 下列说法正确的是(NA表示阿伏伽德罗常数)
| A.地下钢铁管道用导线连接锡块可以减缓管道的腐蚀 |
| B.1molCl2溶于水后,溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA |
| C.反应TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H>0 能自发进行,其原因是△S>0 |
| D.常温下Ksp[Mg(OH)2]=5.6×10-2,则pH=10 含Mg2+的溶液中,c(Mg2+)<5.6×10-8 mol/L |
您最近一年使用:0次
名校
9 . 硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4=H++HSO ,
, 。请回答下列有关问题:
。请回答下列有关问题:
(1)Na2SO4溶液呈_______ (填“弱酸性”“中性”或“弱碱性”),其理由是(用离子方程式表示)_____________ 。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为______________________________ 。
(3)在0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是____ (填字母)
A.c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO4)
)+c(H2SO4)
B.c(OH-)=c(HSO )+c(H+)
)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO )+2c(SO
)+2c(SO )
)
D.c(Na+)=2c(SO )+2c(HSO
)+2c(HSO )
)
(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO )=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO
)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO )
)___ (填“<”“>”或“=”)0.029 mol/L。
(5)若25℃时,0.10mol/ LH2SO4溶液的pH=-lg0.11,则0.10mol/L H2SO4溶液中c(SO )=
)=____ mol/L。
 ,
, 。请回答下列有关问题:
。请回答下列有关问题:(1)Na2SO4溶液呈
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
(3)在0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是
A.c(Na+)=c(SO
 )+c(HSO
)+c(HSO )+c(H2SO4)
)+c(H2SO4)B.c(OH-)=c(HSO
 )+c(H+)
)+c(H+)C.c(Na+)+c(H+)=c(OH-)+c(HSO
 )+2c(SO
)+2c(SO )
)D.c(Na+)=2c(SO
 )+2c(HSO
)+2c(HSO )
)(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO
 )=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO
)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO )
)(5)若25℃时,0.10mol/ LH2SO4溶液的pH=-lg0.11,则0.10mol/L H2SO4溶液中c(SO
 )=
)=
您最近一年使用:0次
名校
10 . 甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g) CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3=_________ 。
(2)反应1能够自发进行的原因是_______________ ,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________ 。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______ 。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________ 。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________ ,反应Ⅱ的平衡常数_________ (结果保留两位有效数字)
反应Ⅰ(主) :CH3OH(g)+ H2O(g)
 CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol反应Ⅱ(副) :H2(g)+ CO2(g)
 CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3(1)计算反应Ⅲ的ΔH3=
(2)反应1能够自发进行的原因是
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是
③写出一条能提高CH3OH转化率而降低CO生成率的措施
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率
您最近一年使用:0次
2018-01-19更新
|
2031次组卷
|
10卷引用:山西省大同市第二中学2020届高三3月月考理综化学试题
山西省大同市第二中学2020届高三3月月考理综化学试题广东省佛山市普通高中2018届高三教学质量检测(一)化学试题河北省衡水中学2018届高三第十五次模拟理科综合化学试题【全国百强校】河南省林州市第一中学2017-2018学年高二5月月考化学试题【全国百强校】河南省信阳高级中学2018届高三第四次模拟考试化学试题甘肃省兰州市第一中学2020-2021学年高二上学期期中考试化学(理)试题2020届高三化学二轮冲刺新题专练——化学反应原理综合题(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题2021年天津高考化学试题变式题13-16



