名校
1 . 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)工业合成氨反应:N2+3H2 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________ (填“大于”、“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为__________________ 。
②一定条件下,当该反应进行到最大限度时,下列说法正确的是______ (填编号)
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
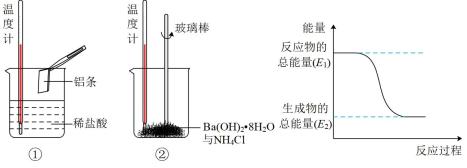
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______ (填“升高”或“降低”)。反应过程____ (填“①”或“②”)的能量变化可用图表示。
(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:

①则d电极是____ (填“正极” 或“负极”),c电极的电极反应式为_____________________________ 。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为______ L。
(1)工业合成氨反应:N2+3H2
 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为
②一定条件下,当该反应进行到最大限度时,下列说法正确的是
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度

(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:

①则d电极是
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为
您最近一年使用:0次
2019-06-01更新
|
1143次组卷
|
7卷引用:【全国百强校】山西省临汾市第一中学2018-2019学年高一下学期期中考试化学试题
2 . 合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:
CO(NH2)2(s)+H2O(l) 2NH3(g)+CO2(g) △H=+133.6 kJ/mol。关于该反应的下列说法正确的是
2NH3(g)+CO2(g) △H=+133.6 kJ/mol。关于该反应的下列说法正确的是______ (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d. 达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达新平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
已知:

再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g) 5N2(g)+2CO2(g)+4H2O(l)的△H =
5N2(g)+2CO2(g)+4H2O(l)的△H =_______ kJ/mol。
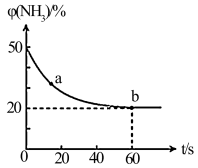
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为________________ 。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>______ 。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
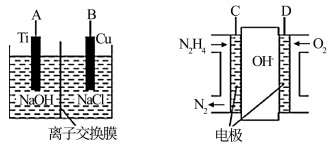
上述装置中阳极反应式为________________________ ,该电解池中的离子交换膜为________ (填“阴”或“阳”)离子交换膜。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:
CO(NH2)2(s)+H2O(l)
 2NH3(g)+CO2(g) △H=+133.6 kJ/mol。关于该反应的下列说法正确的是
2NH3(g)+CO2(g) △H=+133.6 kJ/mol。关于该反应的下列说法正确的是a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d. 达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达新平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
已知:

再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)
 5N2(g)+2CO2(g)+4H2O(l)的△H =
5N2(g)+2CO2(g)+4H2O(l)的△H =③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)
 CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:

上述装置中阳极反应式为
您最近一年使用:0次
名校
解题方法
3 . 合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①CO(NH2)2(s)+H2O(1)⇌2HN3(g)+CO2(g)ΔH=+133.6kJ/mol。关于该反应的下列说法正确的是____________ (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d.达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达到平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
已知:
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)⇌5N2(g)+2CO2(g)+4H2O(1)的ΔH=______ kJ/mol。
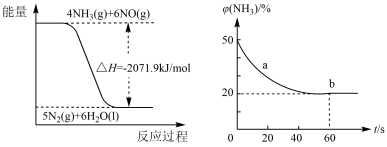
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下应生成尿素:CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为____________
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2,已知9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的C元素全部以CO2形式逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>_________________________ 。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH的浓度来制备纳米Cu2O,装置如图所示:
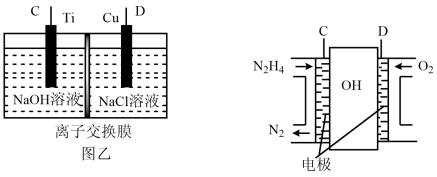
上述装置中阳极反应式为_________________________ ,该电解池中的离子交换膜为______________ (填“阴”或“阳”)离子交换膜。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①CO(NH2)2(s)+H2O(1)⇌2HN3(g)+CO2(g)ΔH=+133.6kJ/mol。关于该反应的下列说法正确的是
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d.达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达到平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。

已知:
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)⇌5N2(g)+2CO2(g)+4H2O(1)的ΔH=
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下应生成尿素:CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2,已知9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的C元素全部以CO2形式逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH的浓度来制备纳米Cu2O,装置如图所示:

上述装置中阳极反应式为
您最近一年使用:0次
名校
解题方法
4 . 氮和碳的化合物在生产生活中应用广泛。
(1)①氯胺(NH2Cl)的电子式为_______________ 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为__________________ 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为_______________ (填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=___________ 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:
N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____ Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是__________ (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=________ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
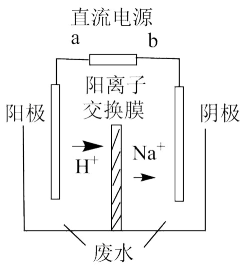
①试写出电解过程中,阴极的电极反应式:_________________________ 。
②在实际处理过程中,当电路中I=50A时,10min处理乙醛8.8g,则电流效率为__ (计算结果保留3位有效数字,每个电子的电量为1.6×10-19C,电流效率=实际反应所需电量/电路中通过电量×100%)。
(1)①氯胺(NH2Cl)的电子式为
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为
(2)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:
N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:
①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最高的是
③计算C点时该反应的压强平衡常数Kp(C)=
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O
 CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
①试写出电解过程中,阴极的电极反应式:
②在实际处理过程中,当电路中I=50A时,10min处理乙醛8.8g,则电流效率为
您最近一年使用:0次
解题方法
5 . 臭氧(O3)主要分布在大气层的平流层中,能够吸收紫外线,被称为地球的保护伞。回答下列问题:
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=_______ (用K1、K2、K3表示),写出一种保护臭氧层的措施:__________ 。
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H=____ kJ•mol-1。
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4mol•L-1SO3,此时SO2的转化率为_______ ,欲提高O3的利用率可采取的措施有_______ (填字母)。
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入_______ molNa2SO4。
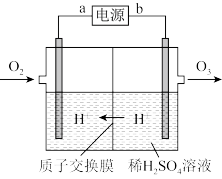
(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为_____ 极,通入O2的电极反应式为_______ 。
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H=
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4mol•L-1SO3,此时SO2的转化率为
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入

(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为
您最近一年使用:0次
名校
6 . A和B转化为C的催化反应历程示意图如下。下列说法不正确的是


| A.催化剂在反应前后保持化学性质不变 |
| B.生成C总反应的原子利用率为100% |
| C.①→②的过程吸收能量 |
| D.C的水溶液呈弱酸性 |
您最近一年使用:0次
2019-02-14更新
|
450次组卷
|
7卷引用:【市级联考】福建省泉州市2019届高三上学期单科质量检查化学试题
【市级联考】福建省泉州市2019届高三上学期单科质量检查化学试题福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)福建省霞浦第一中学2018-2019学年高二下学期第一次月考化学试题(B卷)山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高二上学期期末考试化学试题河北省衡水市第十四中学2020-2021学年高二下学期摸底考试化学试题
7 . 下列图示与对应的叙述不相符合的是
A.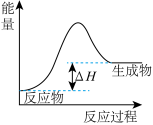 表示燃料燃烧反应的能量变化 表示燃料燃烧反应的能量变化 |
B.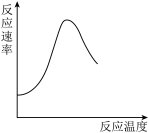 表示酶催化反应的反应速率随反应温度的变化 表示酶催化反应的反应速率随反应温度的变化 |
C.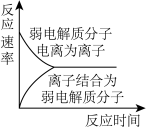 表示弱电解质在水中建立电离平衡的过程 表示弱电解质在水中建立电离平衡的过程 |
D.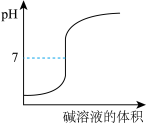 表示强碱滴定强酸的滴定曲线 表示强碱滴定强酸的滴定曲线 |
您最近一年使用:0次
2019-01-30更新
|
1420次组卷
|
46卷引用:山西省运城市新绛中学2021届高三上学期8月月考化学试题
山西省运城市新绛中学2021届高三上学期8月月考化学试题2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2017届河北省衡水中学高三上学期摸底考试化学试卷2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届河南省郑州一中高三上期中化学试卷2017届宁夏石嘴山三中高三上期中化学试卷2016-2017学年天津市部分区高二上学期期末化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题云南省玉溪市民族中学2017-2018学年高二上学期期中考试化学试卷河北省衡水市安平中学2017-2018学年高二上学期期中考试化学试题鄱阳一中2017-2018学年度上学期高二年级第二次检测化学试卷江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题广东省惠州市2018届高三第三次调研考理科综合化学试题1山东省德州市2017-2018学年高二上学期期末考试化学试题广东省惠州市2018届高三第三次调研考理科综合化学试题2广东省普宁市华美实验学校2017-2018学年高二下学期第一次月考化学试题福建省晋江市季延中学2017-2018学年高二下学期期末考试化学试题四川省内江铁路中学2019届高三上学期入学考试化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题(已下线)考点11 化学反应速率——备战2019年浙江新高考化学考点2016年全国普通高等学校招生统一考试化学(江苏卷参考版)【全国百强校】江苏省启东中学2018-2019学年高一(创新班)下学期3月月考化学试题江苏省苏州市第五中学2018-2019学年高二下学期期中考试化学试题广西桂林市中山中学2018-2019学年高二下学期期中考试化学试题新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题贵州省都匀第一中学2019-2020学年高二上学期期中考试化学试题安徽省阜阳市颍上二中2019-2020学年高二上学期第二次段考化学试题福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题湖北省宜昌市长阳土家族自治县第一高级中学2020-2021学年高二上学期期中考试化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题河北省衡水市武强中学2020-2021学年高二上学期第三次月考化学试题辽宁省营口市2020-2021学年高二上学期期末考试化学试题湖北省宜昌市夷陵中学2021-2022学年高二下学期诊断性检测(二)化学试题江苏省徐州市睢宁县第一中学2021-2022学年高二下学期第一次月考化学试题福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题浙江省北斗联盟2022-2023学年高二上学期期中联考化学试题内蒙古莫力达瓦旗尼尔基第一中学2021-2022学年高三上学期期末考试化学试题山东省德州市德州耀华学校2021-2022学年高二上学期第三次质量调研12月考化学试题浙江省绍兴市柯桥区2022-2023学年高二上学期期末教学质量调测化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题
名校
8 . 工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
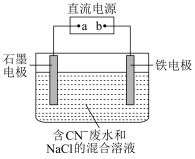
①CN--2e-+2OH-=CNO-+H2O
②2Cl--2e-=Cl2↑
③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO +4H2O
+4H2O
下列说法正确的是

①CN--2e-+2OH-=CNO-+H2O
②2Cl--2e-=Cl2↑
③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO
 +4H2O
+4H2O下列说法正确的是
| A.铁电极上发生的反应为Fe-2e-=Fe2+ |
| B.通电过程中溶液pH不断增大 |
| C.除去1 mol CN-,外电路至少需转移5 mol电子 |
| D.为了使电解池连续工作,需要不断补充NaCl |
您最近一年使用:0次
2019-01-09更新
|
1824次组卷
|
17卷引用:2015届福建省厦门市普通高中高三质量检查理综化学试卷
2015届福建省厦门市普通高中高三质量检查理综化学试卷2016届广东省揭阳一中、金山中学高三下第一次联考化学试卷内蒙古赤峰市宁城县2020届高三10月月考化学试题(已下线)江苏省海安高级中学2019届高三12月月考化学试题江苏省启东中学2020-2021学年高二上学期第二次月考化学试题甘肃省天水市一中2021届高三上学期第三学段考试化学试题湖南省雅礼中学2020-2021学年高二上学期期中考试化学试题山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高二上学期期末考试化学试题山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题江苏省镇江中学2020-2021学年高二上学期期末考试化学试题江苏省扬州市江都区大桥高级中学2020-2021学年高二下学期学情检测(二)化学试题江苏省高邮市2021-2022学年高二上学期期中学情调研化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题江苏省盱眙中学2021-2022学年高二上学期第三次学情调研化学试题(已下线)2022年湖北省高考真题变式题11-15江苏省常州市新桥高级中学2021-2022学年高二上学期期末质量检测化学试题江苏省苏州第一中学校2023-2024学年高二上学期10月月考化学试题
名校
9 . 下列有关说法正确的是
A.一定条件下反应N2+3H2 2NH3,达到平衡时,3v正(H2)=2v正(NH3) 2NH3,达到平衡时,3v正(H2)=2v正(NH3) |
| B.25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸 |
| C.将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3•H2O)变小 |
| D.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成 |
您最近一年使用:0次
2019-01-08更新
|
392次组卷
|
2卷引用:【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题
名校
解题方法
10 . 科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔHl =-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = +113.4 kJ·mol-1
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ΔH3 =_________ kJ·mol-1。
(2)在反应i中,每放出38.0 kJ热量,有______ g FeO被氧化。
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
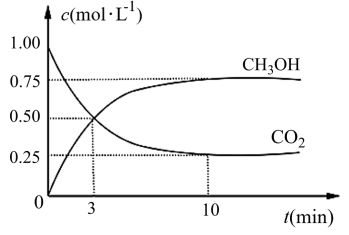
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=________ mol·(L·min) -1。
(4)氢气的转化率=________________________ 。
(5)该反应的平衡常数为__________________________ (保留小数点后2位)。
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
(7)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________ c2的关系(填“>”、“<”或“=”)。
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)将该吸收液蒸干,灼烧至恒重,所得固体的成分是_________ (填化学式)。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔHl =-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = +113.4 kJ·mol-1
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ΔH3 =
(2)在反应i中,每放出38.0 kJ热量,有
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=
(4)氢气的转化率=
(5)该反应的平衡常数为
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1 mol H2 | D.将H2O(g)从体系中分离出去 |
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)将该吸收液蒸干,灼烧至恒重,所得固体的成分是
您最近一年使用:0次



