名校
1 . 已知H2(g)+I2(g) 2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
 2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是| A.甲、乙提高相同温度 | B.甲中加入0.1molHe,乙中不变 |
| C.甲降低温度,乙增大压强 | D.甲增加0.1molH2,乙增加0.1molI2 |
您最近一年使用:0次
2017-11-15更新
|
660次组卷
|
6卷引用:山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题
名校
2 . 雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g) SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____ 。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
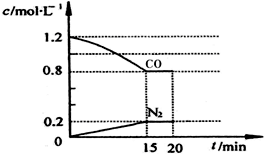
①有害气体NO的转化率为________ 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____ (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式____________________ 。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________ mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______ mol/L。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)
 SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
①有害气体NO的转化率为
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=
您最近一年使用:0次
2017-11-07更新
|
115次组卷
|
3卷引用:【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题
解题方法
3 . 工业上合成氨的原理如下:N2(g)+3H2(g) 2NH3(g)△H。
2NH3(g)△H。
(1)已知H-H键的键能为436 kJ•mol-1,N-H键的键能为391kJ•mol-1,N=N键的键能是945.6 kJ•mol-1,则上述反应的△H=________ 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol•L-1• min-1;乙:v(N2)=2 mol•L-1• min-1;丙:v(H2)=4.5mol•L-1• min-1;丁:v(NH3)=0.075 mol•L-1• min-1。若其他条件相同,温度不同,则温度由高到低的顺序是______________ (填序号)。
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=________ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(4)在773 K时,分别将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
①图中表示c(N2)-t的曲线是________ 。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正________ v逆(填“>”“<”或“=”)。
 2NH3(g)△H。
2NH3(g)△H。(1)已知H-H键的键能为436 kJ•mol-1,N-H键的键能为391kJ•mol-1,N=N键的键能是945.6 kJ•mol-1,则上述反应的△H=
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol•L-1• min-1;乙:v(N2)=2 mol•L-1• min-1;丙:v(H2)=4.5mol•L-1• min-1;丁:v(NH3)=0.075 mol•L-1• min-1。若其他条件相同,温度不同,则温度由高到低的顺序是
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=
(4)在773 K时,分别将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
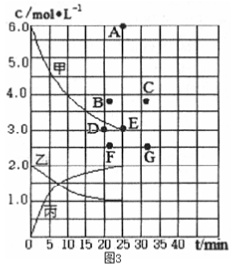
①图中表示c(N2)-t的曲线是
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正
您最近一年使用:0次
2017-11-03更新
|
116次组卷
|
2卷引用:山西省孝义市实验中学2017-2018学年高二上学期第二次月考化学试题
名校
4 . 工业上利用反应2C+SiO2 Si+2CO↑冶炼硅单质,有关叙述错误的是( )
Si+2CO↑冶炼硅单质,有关叙述错误的是( )
 Si+2CO↑冶炼硅单质,有关叙述错误的是( )
Si+2CO↑冶炼硅单质,有关叙述错误的是( )| A.每当固体质量减轻5.6g时,生成2.8g Si |
| B.氧化剂和还原剂的物质的量之比为1:2 |
| C.硅单质在常温下不与任何酸、碱反应 |
| D.单质硅与单质碳均具有一定的还原性 |
您最近一年使用:0次
11-12高一上·浙江杭州·期中
名校
5 . 等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L-1和b mol·L-1,则a与b的关系为
| A.2a=b | B.a=2b | C.a=b | D.a=5b |
您最近一年使用:0次
2017-10-31更新
|
478次组卷
|
12卷引用:山西省朔州市怀仁市第一中学2018-2019学年高一上学期期中考试化学试题
山西省朔州市怀仁市第一中学2018-2019学年高一上学期期中考试化学试题(已下线)2011-2012学年浙江省杭州高级中学高一上学期期中考试化学试卷(已下线)2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(已下线)2015届陕西省西安一中高三上学期第二次模考试化学试卷2014-2015河南省周口中英文学校高一上学期12月月考化学试卷2016-2017学年黑龙江大庆铁人中学高一上期中化学卷陕西省西安市第一中学2018届高三上学期第二次模拟考试化学试题河南省安阳县第一高级中学2017-2018学年高一上学期期中考试化学试题吉林省长春外国语学校2017-2018学年高一下学期期初考试化学试题夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——氮及其化合物(强化练习)内蒙古赤峰二中人教版高中化学必修1练习:化学计量及其应用(3)(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
6 . 已知NO和O2转化为NO2的反应机理如下:

①2NO(g) N2O2(g)(快)△H1<0,平衡常数K1
N2O2(g)(快)△H1<0,平衡常数K1
②N2O2(g)+O2(g) 2NO2(g)(慢) △H2<0,平衡常数K2
2NO2(g)(慢) △H2<0,平衡常数K2
下列说法正确的是

①2NO(g)
 N2O2(g)(快)△H1<0,平衡常数K1
N2O2(g)(快)△H1<0,平衡常数K1②N2O2(g)+O2(g)
 2NO2(g)(慢) △H2<0,平衡常数K2
2NO2(g)(慢) △H2<0,平衡常数K2下列说法正确的是
A.2NO(g)+O2(g) 2NO2(g)的△H=△H1+△H2 2NO2(g)的△H=△H1+△H2 |
B.2NO(g)+O2(g) 2NO2(g)的平衡常数K= K1/K2 2NO2(g)的平衡常数K= K1/K2 |
C.反应①的速率大小决定2NO(g)+O2(g) 2NO2(g)的反应速率 2NO2(g)的反应速率 |
| D.反应过程中的能量变化可用图a表示 |
您最近一年使用:0次
2017-10-15更新
|
603次组卷
|
8卷引用:山西省吕梁市2018届高三上学期第一次阶段性测试化学试题
名校
解题方法
7 . 运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g) CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g) CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g) CH3OH(g) ΔH=
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________ (填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
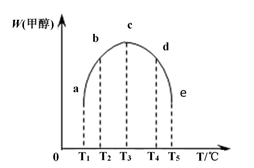
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1________ p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______ ;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________ (填“增大”、“减小”或“不变”)。
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______ 。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g)
 CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1②CO(g)+1/2O2(g)
 CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1③H2(g)+1/2O2(g)
 H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1则CO(g)+2H2 (g)
 CH3OH(g) ΔH=
CH3OH(g) ΔH=(2)下列措施中能够增大上述合成甲醇反应的反应速率的是
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1
②100 ℃时,该反应的化学平衡常数K=
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是

您最近一年使用:0次
2017-10-11更新
|
104次组卷
|
2卷引用:山西省运城市康杰中学2017-2018学年高二上学期第一次月考化学试题
名校
解题方法
8 . 二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)写出二甲醚燃烧热的热化学方程式_______________________________________________ ;当燃烧放出582kJ热量时,转移的电子数为_______________ 。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mo;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为______________________________ ;
(3)工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是______________________________ (选填字母编号)
A. c(H2)与c(H2O)的比值保持不变
B.单位时间内有2mol H2消耗时有1mol H2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将_______________ (填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将_______________ 。
(1)写出二甲醚燃烧热的热化学方程式
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mo;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为
(3)工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g)
 CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
A. c(H2)与c(H2O)的比值保持不变
B.单位时间内有2mol H2消耗时有1mol H2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将
您最近一年使用:0次
2017-10-07更新
|
81次组卷
|
3卷引用:山西省太原市小店区2017—2018学年高二化学上学期10月月考试题
名校
解题方法
9 . 肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。回答下列问题:
(1)已知反应的热化学方程式如下:
①N2H4(g) N2(g)+2H2(g) △H1;
N2(g)+2H2(g) △H1;
②N2(g)+3H2(g) 2NH3(g) △H2。
2NH3(g) △H2。
反应热△H1_____ (填“大于”或“小于”) △H2。向2 L的恒容密闭容器中充入1 mol N2H4,发生反应①,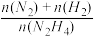 (用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________ 。
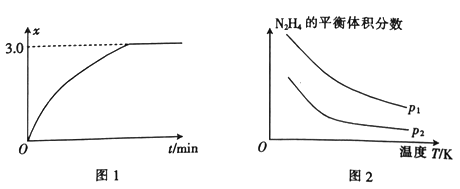
(2)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系。
①该反应的化学方程式为________________________________________ 。
②p2_______ (填“大于”或“小于”) p1。
③图中N2H4的平衡体积分数随温度升高而降低,其原因是__________________________________ 。
(1)已知反应的热化学方程式如下:
①N2H4(g)
 N2(g)+2H2(g) △H1;
N2(g)+2H2(g) △H1;②N2(g)+3H2(g)
 2NH3(g) △H2。
2NH3(g) △H2。反应热△H1
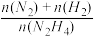 (用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=
(2)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系。
①该反应的化学方程式为
②p2
③图中N2H4的平衡体积分数随温度升高而降低,其原因是
您最近一年使用:0次
2017-09-21更新
|
313次组卷
|
2卷引用:山西省长治二中、康杰中学、忻州一中等五校2018届高三9月摸底考试化学试题
名校
10 . 工业制硫酸中,SO2的催化氧化是一个可逆反应:2SO2+O2  2SO3 ,设该反应在一定条件下,10min达到一定限度,在反应物和生成物之间建立一种动态平衡(即化学平衡),填空:
2SO3 ,设该反应在一定条件下,10min达到一定限度,在反应物和生成物之间建立一种动态平衡(即化学平衡),填空:
___________ 、______________ 、________________ 、____________ 、_______________
 2SO3 ,设该反应在一定条件下,10min达到一定限度,在反应物和生成物之间建立一种动态平衡(即化学平衡),填空:
2SO3 ,设该反应在一定条件下,10min达到一定限度,在反应物和生成物之间建立一种动态平衡(即化学平衡),填空:| SO2 | O2 | SO3 | |
| 反应开始时的浓度(mol·L-1) | 3.0 | 1.5 | 0 |
| 10min后的浓度(mol·L-1) | |||
| 平均反应速率 (mol·L-1·min-1) | 0.1 |
您最近一年使用:0次



