名校
解题方法
1 . 二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(△H)分别为-285.8kJ/mol、-283kJ/mol和-1460.0kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为___________ 。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如图所示:

甲 乙
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式___________ ;下列物质可用做电池熔融碳酸盐的是___________ 。
A.MgCO3
B.Na2CO3
C.NaHCO3
D.(NH4)CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式:___________ 。
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)=___________ 。
(1)已知H2、CO和CH3OCH3的燃烧热(△H)分别为-285.8kJ/mol、-283kJ/mol和-1460.0kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如图所示:

甲 乙
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式
A.MgCO3
B.Na2CO3
C.NaHCO3
D.(NH4)CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式:
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)=
您最近一年使用:0次
解题方法
2 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ/mol
①若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___________ ;
②下列措施能够增大此反应中NO的转化率的是(填字母代号)___________ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g),△H>0,已知该反应在240℃,平衡常数K=6.4×10-3.请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=6.4×10-3.请回答:
①某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为___________ 。
②假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___________ 。
A.消耗1mol N2同时生成1mol O2 B.气体密度不变
C.混合气体压强不变 D.2v正(N2) = v逆(NO)
③将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是___________ (填字母序号)。
A. B.
B. C.
C.
④240℃,某时刻测得容器内N2、O2、NO的浓度分别为0.25mol/L、0.04mol/L和0.0030mol/L,此时反应___________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ/mol
①若某反应的平衡常数表达式为K=
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:②下列措施能够增大此反应中NO的转化率的是(填字母代号)
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)
 2NO(g),△H>0,已知该反应在240℃,平衡常数K=6.4×10-3.请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=6.4×10-3.请回答:①某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为
②假定该反应是在恒容条件下进行,判断该反应达到平衡的标志
A.消耗1mol N2同时生成1mol O2 B.气体密度不变
C.混合气体压强不变 D.2v正(N2) = v逆(NO)
③将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是
A.
 B.
B. C.
C.
④240℃,某时刻测得容器内N2、O2、NO的浓度分别为0.25mol/L、0.04mol/L和0.0030mol/L,此时反应
您最近一年使用:0次
名校
解题方法
3 . (1)我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2 Si3N4+6CO,该反应变化过程中的能量变化如图所示。
Si3N4+6CO,该反应变化过程中的能量变化如图所示。

回答以下问题。
(1)该反应________ (填“吸热”或“放热”),反应热ΔH________ 0(填“>”、“<”或“=”)。
(2)已知:
As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=__________ 。
(3)氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。已知:
①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K=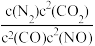 ,写出此反应的热化学方程式:
,写出此反应的热化学方程式:____________ 。
(4)甲烷的燃烧热为890.3 kJ/ mol ,请写出表示CH4燃烧热的热化学方程式_____________ 。
(5)由图可知,金刚石的稳定性________ 石墨的稳定性(填“>”、“<”或“=”)。

(6)中和热的测定装置如图所示:

图中A的仪器名称:__________________ 作用:____________________________
 Si3N4+6CO,该反应变化过程中的能量变化如图所示。
Si3N4+6CO,该反应变化过程中的能量变化如图所示。
回答以下问题。
(1)该反应
(2)已知:
As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH22As(s)+
 O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=
(3)氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。已知:
①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K=
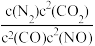 ,写出此反应的热化学方程式:
,写出此反应的热化学方程式:(4)甲烷的燃烧热为890.3 kJ/ mol ,请写出表示CH4燃烧热的热化学方程式
(5)由图可知,金刚石的稳定性

(6)中和热的测定装置如图所示:

图中A的仪器名称:
您最近一年使用:0次
2020-06-11更新
|
135次组卷
|
2卷引用:新疆阿勒泰地区2020-2021学年高二上学期期末考试化学试题
名校
4 . 通过CH4超干重整CO2技术可得到富含CO的化工原料,其过程如下图所示。下列说法错误的是( )
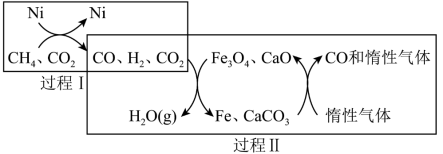
A.过程Ⅰ的化学方程式为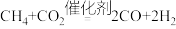 |
B.过程Ⅱ的化学方程式为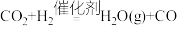 |
| C.该技术实现了含碳物质与含氢物质的分离 |
| D.Ni、Fe、CaCO3均是上述过程中用到的催化剂 |
您最近一年使用:0次
2019-10-13更新
|
2147次组卷
|
6卷引用:新疆博乐市第七中学2021-2022学年高二上学期期末考试化学试题
5 . 请根据题目要求回答以下问题:
(1)CuSO4·5H2O的摩尔质量是__________ ; 0.1mol CH4含有的氢原子数为_____ ; 0.2 mol·L-1的 AlCl3溶液中Cl-的物质的量浓度是__________ 。
(2)现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是__________ ,属于弱电解质的是____ 。(填序号),写出Ba(OH)2的电离方程式_________ .
(1)CuSO4·5H2O的摩尔质量是
(2)现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是
您最近一年使用:0次
6 . 下列图示与对应的叙述不相符合的是
A.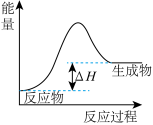 表示燃料燃烧反应的能量变化 表示燃料燃烧反应的能量变化 |
B.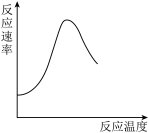 表示酶催化反应的反应速率随反应温度的变化 表示酶催化反应的反应速率随反应温度的变化 |
C.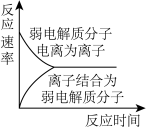 表示弱电解质在水中建立电离平衡的过程 表示弱电解质在水中建立电离平衡的过程 |
D.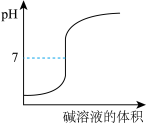 表示强碱滴定强酸的滴定曲线 表示强碱滴定强酸的滴定曲线 |
您最近一年使用:0次
2019-01-30更新
|
1420次组卷
|
46卷引用:新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题
新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题2016-2017学年天津市部分区高二上学期期末化学试卷内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题山东省德州市2017-2018学年高二上学期期末考试化学试题福建省晋江市季延中学2017-2018学年高二下学期期末考试化学试题2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2017届河北省衡水中学高三上学期摸底考试化学试卷2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届河南省郑州一中高三上期中化学试卷2017届宁夏石嘴山三中高三上期中化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题云南省玉溪市民族中学2017-2018学年高二上学期期中考试化学试卷河北省衡水市安平中学2017-2018学年高二上学期期中考试化学试题鄱阳一中2017-2018学年度上学期高二年级第二次检测化学试卷江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题广东省惠州市2018届高三第三次调研考理科综合化学试题1广东省惠州市2018届高三第三次调研考理科综合化学试题2广东省普宁市华美实验学校2017-2018学年高二下学期第一次月考化学试题四川省内江铁路中学2019届高三上学期入学考试化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题(已下线)考点11 化学反应速率——备战2019年浙江新高考化学考点2016年全国普通高等学校招生统一考试化学(江苏卷参考版)【全国百强校】江苏省启东中学2018-2019学年高一(创新班)下学期3月月考化学试题江苏省苏州市第五中学2018-2019学年高二下学期期中考试化学试题广西桂林市中山中学2018-2019学年高二下学期期中考试化学试题贵州省都匀第一中学2019-2020学年高二上学期期中考试化学试题安徽省阜阳市颍上二中2019-2020学年高二上学期第二次段考化学试题福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题山西省运城市新绛中学2021届高三上学期8月月考化学试题湖北省宜昌市长阳土家族自治县第一高级中学2020-2021学年高二上学期期中考试化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题辽宁省营口市2020-2021学年高二上学期期末考试化学试题河北省衡水市武强中学2020-2021学年高二上学期第三次月考化学试题内蒙古莫力达瓦旗尼尔基第一中学2021-2022学年高三上学期期末考试化学试题浙江省绍兴市柯桥区2022-2023学年高二上学期期末教学质量调测化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题湖北省宜昌市夷陵中学2021-2022学年高二下学期诊断性检测(二)化学试题江苏省徐州市睢宁县第一中学2021-2022学年高二下学期第一次月考化学试题福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题浙江省北斗联盟2022-2023学年高二上学期期中联考化学试题山东省德州市德州耀华学校2021-2022学年高二上学期第三次质量调研12月考化学试题
解题方法
7 . 人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。 氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______ 变化,1 mol H2完全燃烧生成1 mol H2O(气态)时,释放的能量是_______ kJ。
(2)下列化学反应在理论上可以设计成原电池的是________ 。
A. Fe+2FeCl3 =3FeCl2 B.SO3 +H2O=H2SO4
C. CH4+2O2 CO2+2H2O D. Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D. Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

①实验报告中记录合理的是_______ (填序号)。
②请写出该电池的负极反应式_________ 。
③若有1 mol电子流过导线,则理论上产生H2的质量为______ g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______ (填“锌极”或“铜极”,下同),溶液中SO42-移向_______ 。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。 氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着
(2)下列化学反应在理论上可以设计成原电池的是
A. Fe+2FeCl3 =3FeCl2 B.SO3 +H2O=H2SO4
C. CH4+2O2
 CO2+2H2O D. Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D. Ba(OH)2+H2SO4=BaSO4+2H2O(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

| a.电流计指针偏转 |
| b.Cu极有H2产生 |
| c. H+向负极移动 |
| d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是
②请写出该电池的负极反应式
③若有1 mol电子流过导线,则理论上产生H2的质量为
④将稀H2SO4换成CuSO4溶液,电极质量增加的是
您最近一年使用:0次
2018-06-17更新
|
547次组卷
|
3卷引用:新疆伊宁生产建设兵团四师一中2017-2018学年高一下学期期末考试化学试题
名校
8 . 按要求填写下列相关内容:
(1)在常温下,将体积为 VaL、pH 为 a 的稀硫酸和体积为 VbL、pH为 b 的烧碱溶液混合,若所得混合液为中性。如果 a+b=15,则 Va:Vb=_______ 。某温度时,水的离子积常数 Kw=1×10-13.在此温度下,将 pH=a 的硫酸溶液 VaL与 pH=b的 NaOH 溶液 VbL 混合,若所得混合液为中性,如果 a+b=12,则 Va:Vb=_______ 。
(2)中和相同体积,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三种稀溶液所用相同浓度的盐酸的体积分别为 V1、V2、V3,则三种关系为______________ (用“V1、V2、V3”和“>、<、=”表示)。
(3)常温下将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 pH=6,试回答以下问题:
①0.2mol/LHCl 溶液中由水电离出的 c(H+)______ 0.2mol/LMOH 溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_______ mol/L。
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 现将 CaCl2 溶液与 0.02 mol·L-1Na2CO3 溶液等体积混合,生成 CaCO3 沉淀时,所需 CaCl2 溶液的最小物质的量浓度为______ mol/L。
(1)在常温下,将体积为 VaL、pH 为 a 的稀硫酸和体积为 VbL、pH为 b 的烧碱溶液混合,若所得混合液为中性。如果 a+b=15,则 Va:Vb=
(2)中和相同体积,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三种稀溶液所用相同浓度的盐酸的体积分别为 V1、V2、V3,则三种关系为
(3)常温下将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 pH=6,试回答以下问题:
①0.2mol/LHCl 溶液中由水电离出的 c(H+)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 现将 CaCl2 溶液与 0.02 mol·L-1Na2CO3 溶液等体积混合,生成 CaCO3 沉淀时,所需 CaCl2 溶液的最小物质的量浓度为
您最近一年使用:0次
2017-12-30更新
|
489次组卷
|
3卷引用:新疆乌鲁木齐市第八中学2018-2019学年高二上学期期末考试化学试题



