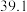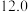名校
解题方法
1 . Ⅰ.铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=_______
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为_______
②下列条件能判断该反应达到平衡状态的是_______
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
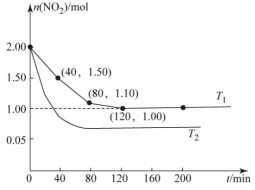
①T1_______ T2(填“>”或“<”)。
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=_______
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_______ 移动(填“正向”“逆向”或“不”)。
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为_______ (室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为
②下列条件能判断该反应达到平衡状态的是
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO
 =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为
您最近一年使用:0次
2021-06-27更新
|
1003次组卷
|
8卷引用:湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题
湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题四川省广安市2019-2020学年高二下学期期末(零诊)化学试题广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题四川省内江市威远中学校2022-2023学年高二下学期第二次阶段性考试理综化学试题(已下线)理综化学-2021年秋季高三开学摸底考试卷01(课标全国专用)2021年海南高考化学试题变式题11-19(已下线)备战2022年高考化学精准检测卷【全国卷】08
2 . 工业上除去电石渣浆 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:

下列说法正确的是
 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:
下列说法正确的是

A. 、 、 在过程Ⅰ、Ⅱ中均起催化剂作用 在过程Ⅰ、Ⅱ中均起催化剂作用 |
B.过程Ⅰ中,反应的离子方程式为 |
C.将10L上清液中的 转化为 转化为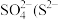 浓度为480 mg·L−1),理论上共需要0.03mol的 浓度为480 mg·L−1),理论上共需要0.03mol的 |
D.常温下,56gCaO溶于水配成1L溶液,溶液中 的数目为 的数目为 个 个 |
您最近一年使用:0次
2021-01-02更新
|
549次组卷
|
5卷引用:湖北省龙泉中学、宜昌一中2021届高三下学期2月联合考试化学试题
湖北省龙泉中学、宜昌一中2021届高三下学期2月联合考试化学试题安徽省示范高中皖北协作区2020年第22届高三联考理科综合化学(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)江西省南昌市新建区第二中学2019-2020学年高二下学期期终考试化学试题黑龙江省大庆实验中学实验一部2020-2021学年高一下学期开学考试化学试题
名校
解题方法
3 . 作为绿色氧化剂和消毒剂,H2O2在工业生产及日常生活中应用广泛。已知:2H2O2(l)=2H2O(l)+O2(g) △H = -196kJ·mol-1K = 8.29×1040,回答下列问题:
(1)H2O2的电子式为______ ,H2O2能用作消毒剂是因为分子结构中存在______ 键(选填“H-O”或“-O-O-”)。
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的______ (选填编号)。
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。
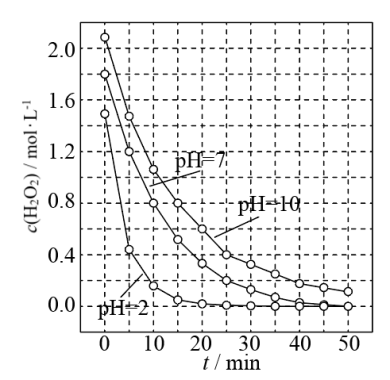
①pH=7时,0~10minH2O2分解反应的平均速率υ=______ mol·L-1·min-1。
②以下对图象的分析正确的是______ (选填序号)。
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因______ 。
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为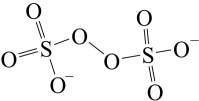 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因_____ 。
(1)H2O2的电子式为
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。

①pH=7时,0~10minH2O2分解反应的平均速率υ=
②以下对图象的分析正确的是
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为
 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
您最近一年使用:0次
2020-12-14更新
|
449次组卷
|
2卷引用:湖北省十一校2021届高三上学期第一次联考化学试题
名校
解题方法
4 . 汽车尾气中含有上百种不同的化合物,其中的污染物有固体悬浮微粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物等。汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应:N2(g) + O2(g) ⇌ 2NO(g),是导致汽车尾气中含有 NO 的原因之一。
(1)已知H2或 CO 可以催化还原 NO 以达到消除污染的目的。
N2(g) + O2(g) = 2NO(g) ΔH = + 180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = - 571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成 N2(g)和H2O(l)的热化学方程式是________ , 判断该反应自发进行的条件:_____ (填“高温自发”或“低温自发”)。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应 2NO(g) + 2CO(g) 2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
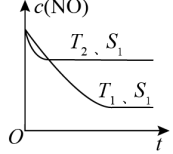
①则该反应 ΔH_____ 0(填“>”或“<”)。
②若催化剂的表面积 S1 > S2,在该图中画出 c(NO)在 T1、S2条件下达到平衡过程中的变化曲线_____________ 。
(3)某研究小组往一恒温恒压容器充入 9 mol N2和 23 mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在 T2、60 MPa 下达到平衡。
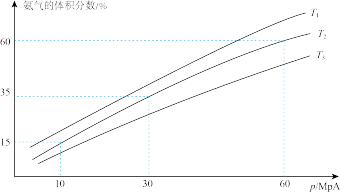
此时N2的平衡分压为_____ MPa。(分压 = 总压 × 物质的量分数)。计算出此时的平衡常数 Kp =_____ (用平衡分压代替平衡浓度计算,结果保留 2 位有效数字)。
(1)已知H2或 CO 可以催化还原 NO 以达到消除污染的目的。
N2(g) + O2(g) = 2NO(g) ΔH = + 180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = - 571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成 N2(g)和H2O(l)的热化学方程式是
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应 2NO(g) + 2CO(g)
 2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①则该反应 ΔH
②若催化剂的表面积 S1 > S2,在该图中画出 c(NO)在 T1、S2条件下达到平衡过程中的变化曲线
(3)某研究小组往一恒温恒压容器充入 9 mol N2和 23 mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在 T2、60 MPa 下达到平衡。

此时N2的平衡分压为
您最近一年使用:0次
名校
5 . 近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:


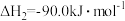
写出 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式_____ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是______ (填序号)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比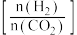 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
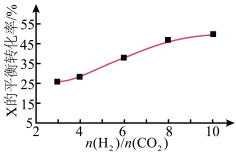
反应物X是___ (填“ ”或“
”或“ ”)。
”)。
(4)250℃时,在体积为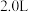 的恒容密闭容器中加入
的恒容密闭容器中加入 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。
①前10min内 的平均反应速率
的平均反应速率
____  。
。
②化学平衡常数
________ 。
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为___ (填实验编号)。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:



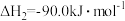
写出
 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由
 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比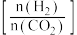 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
反应物X是
 ”或“
”或“ ”)。
”)。(4)250℃时,在体积为
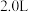 的恒容密闭容器中加入
的恒容密闭容器中加入 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。①前10min内
 的平均反应速率
的平均反应速率
 。
。②化学平衡常数

③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
实验编号 | 温度/K | 催化剂 |
| 甲醇的选择性/% |
A | 543 |
|
|
|
B | 543 |
|
|
|
C | 553 |
|
|
|
D | 553 |
|
|
|
根据上表所给数据,用
 生产甲醇的最优条件为
生产甲醇的最优条件为
您最近一年使用:0次
2020-10-10更新
|
339次组卷
|
8卷引用:甘肃省武威市民勤县第一中学2020-2021学年高二上学期12月月考化学试题(理科)
甘肃省武威市民勤县第一中学2020-2021学年高二上学期12月月考化学试题(理科)湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第4节 化学反应条件的优化——工业合成氨 高效手册人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第四节 化学反应的调控四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题广东省江门市新会区陈经纶中学2022-2023学年高二上学期第5段月考化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控
解题方法
6 . 氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题:
(1)氧化还原法消除NOx的转化如下:
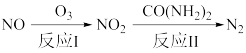
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为_______________ 。
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。
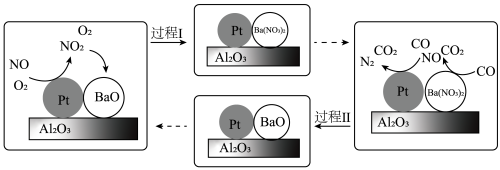
①BaO吸收NO2的化学方程式是______________ 。
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是_______________ 。
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
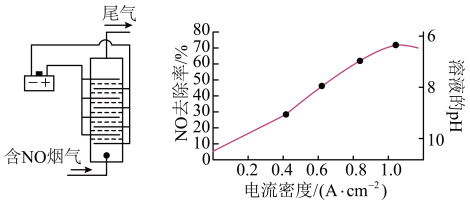
①NO被阳极产生的氧化性物质氧化为 反应的离子方程式为
反应的离子方程式为_______________ 。
②溶液的pH对NO去除率影响的原因是_______________ 。
(1)氧化还原法消除NOx的转化如下:
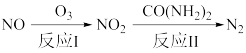
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。

①BaO吸收NO2的化学方程式是
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
①NO被阳极产生的氧化性物质氧化为
 反应的离子方程式为
反应的离子方程式为②溶液的pH对NO去除率影响的原因是
您最近一年使用:0次
2020-09-25更新
|
442次组卷
|
2卷引用:湖北省黄冈市2021届高三9月质量检测化学试题
名校
7 . 设NA为阿伏加 德罗常数的值。下列有关叙述正确的是 ( )
| A.25℃时,pH=8的NaHCO3溶液中含有OH-的数目为10-6NA |
| B.粗铜的电解精炼过程中,若阳极质量减少10g,则阴极质量一定增加10g |
| C.常温常压下,4.6 g NO2所含的氮原子数目为0.1NA |
| D.向1L 1mol/L (CH3COO)2Ba溶液中加入醋酸至中性,混合液中CH3COO-数目为NA |
您最近一年使用:0次
2020-09-25更新
|
1803次组卷
|
8卷引用:辽宁省六校协作体2021届高三第一次联考化学试题
辽宁省六校协作体2021届高三第一次联考化学试题辽宁省开原市中固镇第二中学2021届高三上学期9月月考化学试题辽宁省大连市普兰店区第三十八中学2021届高三上学期第四次考试化学试题武汉市第六中学2022-2023学年高二上学期第二次月考化学试题(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第6周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)微专题03 破解“七陷阱”突破NA-备战2023年高考化学一轮复习考点微专题
名校
8 . 某研究小组探究催化剂对CO、NO转化的影响。将含NO和CO的尾气以一定的流速通过两种不同的催化剂进行反应:2NO(g)+2CO(g)  N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
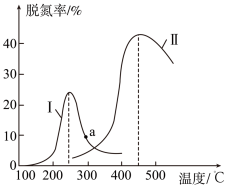
①两种催化剂均能降低活化能,但ΔH不变
②相同条件下,改变压强对脱氮率没有影响
③曲线Ⅱ中的催化剂适用于450 ℃左右脱氮
④曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
⑤ a 点是对应温度下的平衡脱氮率
⑥若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因是催化剂的活性不高
 N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
①两种催化剂均能降低活化能,但ΔH不变
②相同条件下,改变压强对脱氮率没有影响
③曲线Ⅱ中的催化剂适用于450 ℃左右脱氮
④曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
⑤ a 点是对应温度下的平衡脱氮率
⑥若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因是催化剂的活性不高
| A.①③⑥ | B.①③④ | C.②③④ | D.①③⑤ |
您最近一年使用:0次
名校
解题方法
9 . 将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ•mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ•mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ•mol-1
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:_______ 。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请分析:甲、乙两同学观点正确的是_____ (填“甲”或“乙”);判断的理由是________ 。
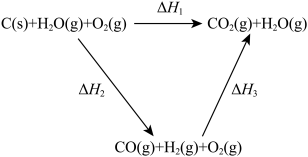
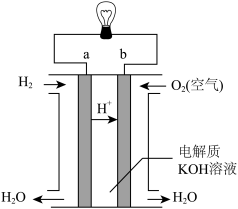
(3)CO、H2等可燃性气体可以设计成燃料电池,燃料电池是一种能量转化率较高的发电装置。如图是一种氢氧燃料电池示意图,则该电池a极的电极反应式为________ 。若将H2换成CH4,则该电池负极的电极反应式为 _______ 。
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为 C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ•mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ•mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ•mol-1
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请分析:甲、乙两同学观点正确的是

(3)CO、H2等可燃性气体可以设计成燃料电池,燃料电池是一种能量转化率较高的发电装置。如图是一种氢氧燃料电池示意图,则该电池a极的电极反应式为

您最近一年使用:0次
10 . 工业废气、汽车尾气排放出的 SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)NOx和 SO2在空气中存在下列平衡:
2NO(g) + O2(g) 2NO2(g) △ H =− 113.0kJ
2NO2(g) △ H =− 113.0kJ mol−1
mol−1
2SO2(g) + O2(g) 2SO3(g) △ H =− 196.6kJ
2SO3(g) △ H =− 196.6kJ mol−1
mol−1
SO2通常在二氧化氮的存在下,进一步被氧化,生成 SO3.
①写出 NO2和 SO2反应的热化学方程式为_____ .
②随温度升高,该反应化学平衡常数变化趋势是_____ .
(2)提高2SO2(g) + O2(g) 2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是
2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是_____ .②在①中条件下,反应达到平衡后,改变下列条件,能使 SO2的转化率提高的是_____ (填字母).
a.温度和容器体积不变,充入 1.0mol He
b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度

(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_____ .
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是_____ .
(1)NOx和 SO2在空气中存在下列平衡:
2NO(g) + O2(g)
 2NO2(g) △ H =− 113.0kJ
2NO2(g) △ H =− 113.0kJ mol−1
mol−12SO2(g) + O2(g)
 2SO3(g) △ H =− 196.6kJ
2SO3(g) △ H =− 196.6kJ mol−1
mol−1SO2通常在二氧化氮的存在下,进一步被氧化,生成 SO3.
①写出 NO2和 SO2反应的热化学方程式为
②随温度升高,该反应化学平衡常数变化趋势是
(2)提高2SO2(g) + O2(g)
 2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是
2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是a.温度和容器体积不变,充入 1.0mol He
b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度

(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是
您最近一年使用:0次

 纳米棒
纳米棒