1 . 铁是一种非常重要的金属。
(1)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
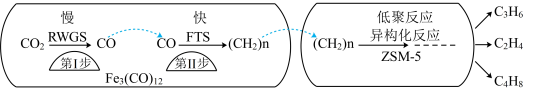
下列说法正确的是___ 。
A.第ⅰ步反应的活化能低于第ⅱ步
B.第ⅰ步所发生的反应为:CO2+H2 CO+H2O
CO+H2O
C.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
D.保持其他条件不变,添加不同助剂后各反应的平衡常数不变
加入助剂K能提高单位时间内乙烯产量的根本原因是___ 。
(2)纳米铁是重要的储氢材料,可用反应Fe(s)+5CO(g) Fe(CO)5(g)制得。在1L恒容密闭容器中加入足量铁粉和0.24mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图所示。
Fe(CO)5(g)制得。在1L恒容密闭容器中加入足量铁粉和0.24mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图所示。

①T1___ T2,△H___ 0(填“>”或“<”)
②已知:标准平衡常数Kθ=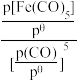 ,其中pθ为标准压强(1×105Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。T2温度下,平衡时体系的压强为p,反应的标准平衡常数Kθ=
,其中pθ为标准压强(1×105Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。T2温度下,平衡时体系的压强为p,反应的标准平衡常数Kθ=___ (用含p的最简式表示)
(3)高铁酸钾(K2FeO4)被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
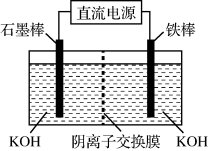
①电解法可制得K2FeO4,装置如图,若转移6mol电子则隔膜右边溶液增重___ g。
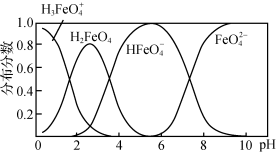
②K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示,向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为___ 。
(4)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)=MnFe2O(4-x)(s)+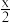 O2(g)△H1
O2(g)△H1
②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g)△H2
③2H2O(g)=2H2(g)+O2(g)△H3
则:△H3与△H1、△H2的关系为___ 。
(1)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。

下列说法正确的是
A.第ⅰ步反应的活化能低于第ⅱ步
B.第ⅰ步所发生的反应为:CO2+H2
 CO+H2O
CO+H2OC.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
D.保持其他条件不变,添加不同助剂后各反应的平衡常数不变
加入助剂K能提高单位时间内乙烯产量的根本原因是
(2)纳米铁是重要的储氢材料,可用反应Fe(s)+5CO(g)
 Fe(CO)5(g)制得。在1L恒容密闭容器中加入足量铁粉和0.24mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图所示。
Fe(CO)5(g)制得。在1L恒容密闭容器中加入足量铁粉和0.24mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图所示。
①T1
②已知:标准平衡常数Kθ=
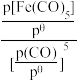 ,其中pθ为标准压强(1×105Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。T2温度下,平衡时体系的压强为p,反应的标准平衡常数Kθ=
,其中pθ为标准压强(1×105Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。T2温度下,平衡时体系的压强为p,反应的标准平衡常数Kθ=(3)高铁酸钾(K2FeO4)被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。


①电解法可制得K2FeO4,装置如图,若转移6mol电子则隔膜右边溶液增重
②K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示,向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为
(4)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)=MnFe2O(4-x)(s)+
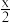 O2(g)△H1
O2(g)△H1②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g)△H2
③2H2O(g)=2H2(g)+O2(g)△H3
则:△H3与△H1、△H2的关系为
您最近一年使用:0次
2020-07-01更新
|
483次组卷
|
2卷引用:湖北省黄石市黄石二中等三校联考高三第三次理综化学试题
名校
2 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
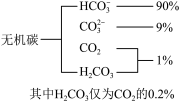
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________ 。已知春季海水pH=8.1,预测冬季海水碱性将会_______ (填“增强”或“减弱”),理由是_________________ 。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________ (填字母)。
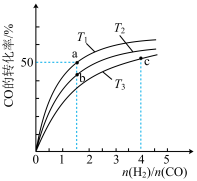
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
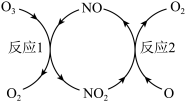
①NO的作用是_________________ 。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为____________________________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
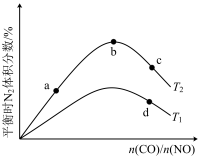
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从小到大的顺序为________ ;b、c、d三点的平衡常数从大到小的顺序为__________ 。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____ 。

(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。

①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从小到大的顺序为
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为
您最近一年使用:0次
2020-03-05更新
|
448次组卷
|
2卷引用:湖北省黄石二中2020届高三4月线上考试理综化学试题
名校
3 . 已知2 SO2(g)+O2(g) 2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
 2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )| A.升高温度,可以加快反应速率 |
| B.在上述条件下,SO2不能完全转化为SO3 |
| C.使用催化剂是为了加快反应速率 |
| D.达到平衡时,SO2的浓度与SO3的浓度一定相等 |
您最近一年使用:0次
2018-06-25更新
|
154次组卷
|
3卷引用:2015-2016学年湖北省黄石市有色一中高二上学期10月月考化学试卷



