解题方法
1 . 氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题:
(1)氧化还原法消除NOx的转化如下:
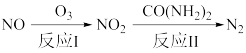
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为_______________ 。
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。
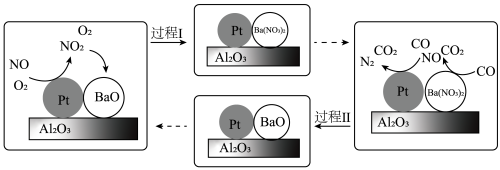
①BaO吸收NO2的化学方程式是______________ 。
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是_______________ 。
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
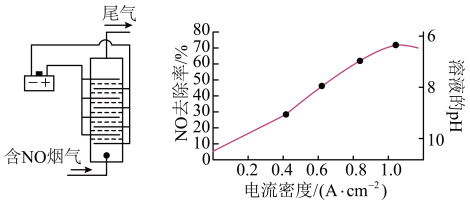
①NO被阳极产生的氧化性物质氧化为 反应的离子方程式为
反应的离子方程式为_______________ 。
②溶液的pH对NO去除率影响的原因是_______________ 。
(1)氧化还原法消除NOx的转化如下:
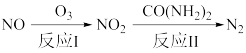
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。

①BaO吸收NO2的化学方程式是
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
①NO被阳极产生的氧化性物质氧化为
 反应的离子方程式为
反应的离子方程式为②溶液的pH对NO去除率影响的原因是
您最近一年使用:0次
2020-09-25更新
|
442次组卷
|
2卷引用:湖北省黄冈市2021届高三9月质量检测化学试题
2 . 甲醛(HCHO)俗称蚁醛,在化工、医药、农药等方面有广泛的应用。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,已知:CH3OH(g) HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H
(1)该反应的能量变化如图甲所示,△H=___ kJ•mol-1。

(2)为提高CH3OH转化率,采取的措施有___ 、___ ;在温恒容条件下,该反应达到平衡状态的标志有___ (填标号)。
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为___ (填标号),理由是___ 。
a.400℃b.650℃c.700℃d.750℃

(4)T℃时,在2L恒容密闭容器中充入1mol甲醇,发生反应:
①CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
②CH3OH(g) CO(g)+2H2(g)
CO(g)+2H2(g)
平衡时甲醇为0.2mol,甲醛为0.7mol。则反应i的平衡常数K=___ 。
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为___ :若收集到112mLCO2(标准状况),理论上转移电子___ mol。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,已知:CH3OH(g)
 HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H(1)该反应的能量变化如图甲所示,△H=

(2)为提高CH3OH转化率,采取的措施有
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为
a.400℃b.650℃c.700℃d.750℃

(4)T℃时,在2L恒容密闭容器中充入1mol甲醇,发生反应:
①CH3OH(g)
 HCHO(g)+H2(g)
HCHO(g)+H2(g)②CH3OH(g)
 CO(g)+2H2(g)
CO(g)+2H2(g)平衡时甲醇为0.2mol,甲醛为0.7mol。则反应i的平衡常数K=
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为
您最近一年使用:0次
2020-04-22更新
|
399次组卷
|
2卷引用:贵州省2020年普通高等学校招生适应性测试理综化学试题
3 . 氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下图所示。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程如图所示。
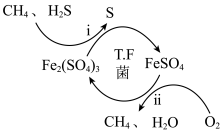
(1)过程i的氧化剂是_____________ 。
(2)过程ii的离子方程式是________________ 。
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
请结合以上信息,判断工业脱硫应选择的最合适的pH范围是____ <pH<____ 。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。

(4)①该过程的热化学方程式是____________________ 。
②比较压强p1和p2的大小关系:p1____ p2(选填“>”、“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1mol CH4和1mol水蒸气充分反应达平衡后,测得起始时混合气体的密度是平衡时混合气体密度的1.4倍,则CH4的转化率为________ 。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程如图所示。

(1)过程i的氧化剂是
(2)过程ii的离子方程式是
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
| pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
| Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。

(4)①该过程的热化学方程式是
②比较压强p1和p2的大小关系:p1
③在一定温度和一定压强下的体积可变的密闭容器中充入1mol CH4和1mol水蒸气充分反应达平衡后,测得起始时混合气体的密度是平衡时混合气体密度的1.4倍,则CH4的转化率为
您最近一年使用:0次
2020-01-18更新
|
107次组卷
|
2卷引用:湖北省荆州中学、宜昌一中两校2019-2020学年高二上学期期末考试化学试题
4 . 炽热的炉膛内有反应:C(s)+O2(g)=CO2(g) ΔH=-392kJ·mol-1,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131kJ·mol-1,2CO(g)+O2(g)=2CO2(g) ΔH=-564kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH=-482kJ·mol-1由以上反应推断往炽热的炉膛内通入水蒸气时( )
| A.不能节约燃料,但能使炉膛火更旺 | B.虽不能使炉膛火更旺,但可节约燃料 |
| C.既可使炉膛火更旺,又能节约燃料 | D.既不能使炉膛火更旺,又不能节约燃料 |
您最近一年使用:0次
2019-12-24更新
|
128次组卷
|
4卷引用:湖北省黄冈市浠水县实验高级中学2019-2020学年高二上学期期中复习检测化学试题
名校
解题方法
5 . 雾霾中含有多种污染物,其中有氮氧化物(NOx)、CO、SO2等,给人类健康带来了严重影响,化学在解决雾霾污染中发挥了重要作用。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原消除污染。请写出CH4与NO2反应的化学方程式_____________ 。
(2)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-746.8kJ·mol-1
N2(g)+2CO2(g) △H=-746.8kJ·mol-1
4CO(g)+2NO2(g) 3CO2(g)+N2(g) △H=-1200kJ·mol-1
3CO2(g)+N2(g) △H=-1200kJ·mol-1
则反应的CO(g)+NO2(g) CO2(g)+NO(g) △H=
CO2(g)+NO(g) △H=_____ kJ·mol-1
(3)氮硫的氧化物间存在如下转化SO2(g)+NO2(g) SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:

①该反应正反应的活化能___ (填“>”或“<”)逆反应的活化能。
②反应速率v=V正-V逆=k正xSO2·xNO2-k逆xSO3·xNO,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,T℃时,k正_____ k逆(填“>”、“<”或“=”)。
③T℃时,在体积为2L的容器中加入1molSO2(g)、1molNO2(g),5min时测得xSO3=0.2,此时平衡向___ (填“正”或“逆”)反应方向移动, =
=___ (保留2位小数)。
(4)已知:2NO(g)=N2(g)+O2(g) ΔH=-180.6kJ/mol,在某表面催化剂的作用下,NO可以分解生成N2、O2,其反应机理可简化为:
第一步:2NO →N2O2快
第二步:N2O2 →N2+O2慢
下列表述正确的是____ (填标号)。
A.所有化合反应都是放热反应
B.N2O2是该反应的的中间产物
C.加入合适的催化剂可以减小反应热ΔH,加快反应速率
D.第一步的活化能比第二步低
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原消除污染。请写出CH4与NO2反应的化学方程式
(2)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-746.8kJ·mol-1
N2(g)+2CO2(g) △H=-746.8kJ·mol-14CO(g)+2NO2(g)
 3CO2(g)+N2(g) △H=-1200kJ·mol-1
3CO2(g)+N2(g) △H=-1200kJ·mol-1则反应的CO(g)+NO2(g)
 CO2(g)+NO(g) △H=
CO2(g)+NO(g) △H=(3)氮硫的氧化物间存在如下转化SO2(g)+NO2(g)
 SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
①该反应正反应的活化能
②反应速率v=V正-V逆=k正xSO2·xNO2-k逆xSO3·xNO,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,T℃时,k正
③T℃时,在体积为2L的容器中加入1molSO2(g)、1molNO2(g),5min时测得xSO3=0.2,此时平衡向
 =
=(4)已知:2NO(g)=N2(g)+O2(g) ΔH=-180.6kJ/mol,在某表面催化剂的作用下,NO可以分解生成N2、O2,其反应机理可简化为:
第一步:2NO →N2O2快
第二步:N2O2 →N2+O2慢
下列表述正确的是
A.所有化合反应都是放热反应
B.N2O2是该反应的的中间产物
C.加入合适的催化剂可以减小反应热ΔH,加快反应速率
D.第一步的活化能比第二步低
您最近一年使用:0次
名校
6 . 空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
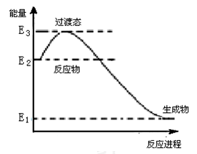
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
I.2NO(g)⇌N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)⇌2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________ 。
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___ E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___ 。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____ (填字母)。

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:
①装置中H+从__________ 移向__________ (填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________ 。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
I.2NO(g)⇌N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)⇌2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:

①装置中H+从
②乙池溶液中发生的反应为
您最近一年使用:0次
2018-06-08更新
|
872次组卷
|
4卷引用:【全国百强校】湖北省黄冈中学2018届高三5月适应性考试理科综合化学试题
【全国百强校】湖北省黄冈中学2018届高三5月适应性考试理科综合化学试题(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合山东省济南市长清第一中学2019届高三12月月考理科综合-化学试题【全国百强校】河南省南阳市第一中学2019届高三第九次考试理综化学试题
7 . 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是:
| A.碳棒作电极电解饱和食盐水,阳极的电极反应式为2Cl--2e-===Cl2↑ |
| B.由C(石墨)(s)===C(金刚石)(s) ΔH=+1.90 kJ·mol-1可知,金刚石比石墨稳定 |
| C.粗铜精炼时,与电池正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+ |
| D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 |
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________ 。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________ mol·L-1;x________ 0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________ (填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________ 。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________ 。
| 实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为
(2)实验①反应后的溶液中由水电离出的c(OH-)=
(3)下列关于实验②反应后的溶液说法不正确的是
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为
您最近一年使用:0次
2017-03-11更新
|
199次组卷
|
4卷引用:湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期10月月考化学试题
解题方法
9 . 设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温下1L 0.1 mol﹒L-1的FeSO4溶液中含有0.4NA个氧原子 |
| B.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L |
| C.1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA |
| D.常温下,pH=7的0.5 mol/L的CH3COONH4溶液中,NH4+浓度为0.5 mol﹒L-1 |
您最近一年使用:0次
2016-05-30更新
|
247次组卷
|
2卷引用:2016届湖北省黄冈市黄冈中学高三5月一模理综化学试卷



