解题方法
1 . 铁元素在溶液中主要以Fe2+、Fe3+、Fe(SCN)3、FeO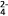 (紫红色)等形式存在。回答下列问题:
(紫红色)等形式存在。回答下列问题:
(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是___________ ,再滴加0.01 mol/L NaOH溶液3 ~5滴,现象是________________________ 。
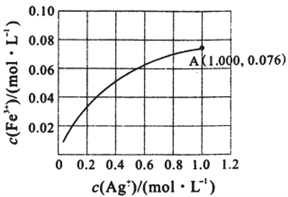
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
①用离子方程式表示Fe(NO3)2溶液中的转化反应_________________________________________ 。
②根据A点数据,计算该转化反应的平衡常数为____________________ 。
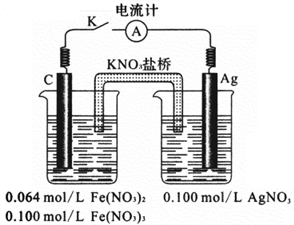
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是______ 。石墨为电池的_____ 极,通过列式计算说明原因_______________________________ 。
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是_________________________ ,再加碱调节pH为_________ 时,铁刚好沉淀完全;继续加碱至pH为4.5时,铜开始沉淀。
已知:
(4)K2FeO4具有强氧化性。在K2FeO4溶液中加入过量稀硫酸,观察到有无色无味气体产生,还可观察到的现象是_____________________________ ;用K2FeO4处理含NH3废水,既可以把NH3氧化为N2防止水体富营养化,又能生成一种净水剂,该反应的离子方程式为______________________________ 。
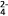 (紫红色)等形式存在。回答下列问题:
(紫红色)等形式存在。回答下列问题:(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
①用离子方程式表示Fe(NO3)2溶液中的转化反应
②根据A点数据,计算该转化反应的平衡常数为
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是
已知:
化合物 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-20 | 10-17 | 10-39 |
您最近一年使用:0次
2017-04-16更新
|
231次组卷
|
2卷引用:2017届湖北省武汉市高三高中毕业生四月调研测试化学试卷
2 . 氨氮废水中的氮元素多以NH 和NH3·H2O的形式存在,在一定条件下,NH
和NH3·H2O的形式存在,在一定条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
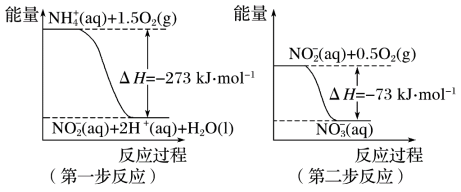
下列说法合理的是
 和NH3·H2O的形式存在,在一定条件下,NH
和NH3·H2O的形式存在,在一定条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下: 
下列说法合理的是
A.该反应的催化剂是NO |
B.升高温度,两步反应速率均加快,有利于NH 转化成NO 转化成NO |
| C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 |
D.1 mol NH 在第一步反应中与1 mol NO 在第一步反应中与1 mol NO 在第二步反应中失电子数之比为1:3 在第二步反应中失电子数之比为1:3 |
您最近一年使用:0次
2020-12-04更新
|
270次组卷
|
2卷引用:湖北省汉川市第二中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
3 . 研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法的不正确的是
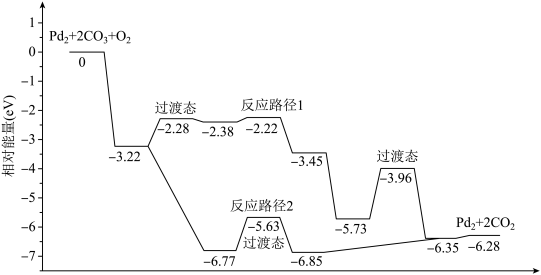

| A.该过程中有极性键和非极性键的断裂和生成 |
| B.反应路径2的催化效果更好 |
| C.催化剂不会改变整个反应的ΔH |
| D.路径1中最大能垒(活化能)E正=1.23eV |
您最近一年使用:0次
2020-12-08更新
|
1113次组卷
|
7卷引用:湖北省武汉市东西湖区华中师范大学第一附属中学2021届高三上学期期中考试化学试题
4 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(慢反应)
2I(g)(慢反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(快反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列表述正确的是___________
A.N2O浓度越高其分解速率越快 B.第一步对总反应速率起决定作用
C.第一步活化能比第三步大 D.IO为反应的催化剂
II.1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g) CH2ClCHCICH3(g)ΔH1=-134kJ∙mol-1
CH2ClCHCICH3(g)ΔH1=-134kJ∙mol-1
②CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)ΔH2=-102kJ∙mol-1
CH2=CHCH2Cl(g)+HCl(g)ΔH2=-102kJ∙mol-1
请回答下列问题:
(2)已知CH2=CHCH2C(g)+HCl(g) CH2ClCHClCH(g)的活化能Ea(正)为132kJ∙mol-1,则该反应的活化能Ea(逆)为
CH2ClCHClCH(g)的活化能Ea(正)为132kJ∙mol-1,则该反应的活化能Ea(逆)为__________ kJ∙mol-1。
(3)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①、②,容器内气体的压强随时间的变化如下表所示。
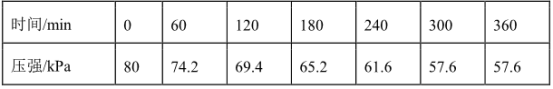
若用单位时间内气体分压的变化来表示反应速率,即v=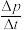 ,则前120min内平均反应速率v(CH2ClCHClCH3)=
,则前120min内平均反应速率v(CH2ClCHClCH3)=________ kPamin-1(保留小数点后2位)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。下列说法错误的是__________ (填代号)。
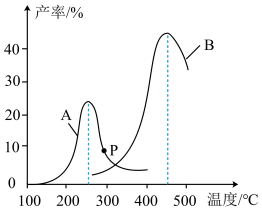
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强会影响CH2ClCHClCH3的产率
c.p点是对应温度下CH2ClCHClCH3的平衡产率
d.提高CH2ClCHClCH3反应选择性的关键因素是控制温度
(5)在四个恒容密闭容器中充入相应量的气体(如图):

发生反应2N2O(g) 2N2(g)+O2(g)ΔH,容器I、II、II中N2O的平衡转化率如图所示:
2N2(g)+O2(g)ΔH,容器I、II、II中N2O的平衡转化率如图所示:
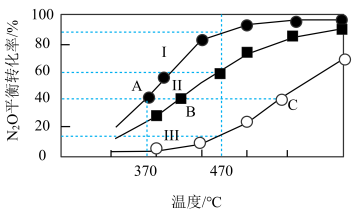
容器I、IV的体积为1L,容器IV中的物质也在470°C下进行反应,起始反应速率:
①v正(N2O)_____ v逆(N2)。(填“>”“<”或“=”)
②图中A、B、C三点处容器内密度最小点是__________ (填“A”“B”或“C”)。
I.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)
 2I(g)(慢反应)
2I(g)(慢反应)第二步I(g)+N2O(g)→N2(g)+IO(g)(快反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列表述正确的是
A.N2O浓度越高其分解速率越快 B.第一步对总反应速率起决定作用
C.第一步活化能比第三步大 D.IO为反应的催化剂
II.1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g)
 CH2ClCHCICH3(g)ΔH1=-134kJ∙mol-1
CH2ClCHCICH3(g)ΔH1=-134kJ∙mol-1②CH2=CHCH3(g)+Cl2(g)
 CH2=CHCH2Cl(g)+HCl(g)ΔH2=-102kJ∙mol-1
CH2=CHCH2Cl(g)+HCl(g)ΔH2=-102kJ∙mol-1请回答下列问题:
(2)已知CH2=CHCH2C(g)+HCl(g)
 CH2ClCHClCH(g)的活化能Ea(正)为132kJ∙mol-1,则该反应的活化能Ea(逆)为
CH2ClCHClCH(g)的活化能Ea(正)为132kJ∙mol-1,则该反应的活化能Ea(逆)为(3)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①、②,容器内气体的压强随时间的变化如下表所示。

若用单位时间内气体分压的变化来表示反应速率,即v=
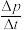 ,则前120min内平均反应速率v(CH2ClCHClCH3)=
,则前120min内平均反应速率v(CH2ClCHClCH3)=(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。下列说法错误的是

a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强会影响CH2ClCHClCH3的产率
c.p点是对应温度下CH2ClCHClCH3的平衡产率
d.提高CH2ClCHClCH3反应选择性的关键因素是控制温度
(5)在四个恒容密闭容器中充入相应量的气体(如图):

发生反应2N2O(g)
 2N2(g)+O2(g)ΔH,容器I、II、II中N2O的平衡转化率如图所示:
2N2(g)+O2(g)ΔH,容器I、II、II中N2O的平衡转化率如图所示:
容器I、IV的体积为1L,容器IV中的物质也在470°C下进行反应,起始反应速率:
①v正(N2O)
②图中A、B、C三点处容器内密度最小点是
您最近一年使用:0次
5 . 在含Fe3+的 和I-的混合溶液中,反应
和I-的混合溶液中,反应 的分解机理及反应进程中的能量变化如下:
的分解机理及反应进程中的能量变化如下:
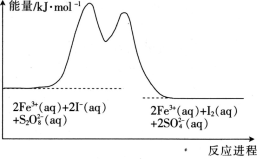
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:
下列有关该反应的说法正确的是
 和I-的混合溶液中,反应
和I-的混合溶液中,反应 的分解机理及反应进程中的能量变化如下:
的分解机理及反应进程中的能量变化如下:
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:

下列有关该反应的说法正确的是
| A.反应速率与Fe3+浓度有关 |
| B.该反应为吸热反应 |
C.v( )=v(I-)=v(I2) )=v(I-)=v(I2) |
| D.若不加Fe3+,则正反应的活化能比逆反应的大 |
您最近一年使用:0次
名校
6 . pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是


| A.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) |
| B.25℃时,H2CO3的一级电离平衡常数Ka1= 10-6 |
| C.25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1% |
| D.25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
您最近一年使用:0次
2018-03-27更新
|
1064次组卷
|
7卷引用:山西省吕梁市2018届高三上学期第一次模拟考试化学试题
山西省吕梁市2018届高三上学期第一次模拟考试化学试题山东省新泰市第一中学2019届高三上学期第二次质量检测化学试题【市级联考】安徽省黄山市2018-2019学年高二上学期期末考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——电解质溶液中的曲线问题(提升练习)(已下线)本册综合检测(一)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)2022年湖北省高考真题变式题11-15
名校
解题方法
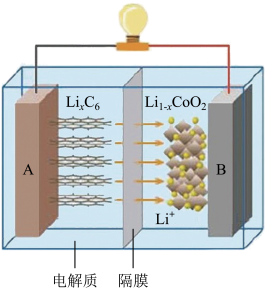
7 . 2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。钴酸锂(LiCoO2)电池的工作原理如图所示,其中A极材料是金属锂和石墨的复合材料(石墨作金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过。电池反应式为: LixC6+ Li1-xCoO2 C6+LiCoO2。下列说法中
C6+LiCoO2。下列说法中正确 的是
 C6+LiCoO2。下列说法中
C6+LiCoO2。下列说法中
| A.充电时Li由B极区域移向A极区域 |
| B.充电时,A为阴极,发生氧化反应C6+xLi++xe-=LixC6 |
| C.放电时,B为正极,电极反应式为Li1-xCoO2+xLi++xe-=LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”使锂进入石墨中而有利于回收 |
您最近一年使用:0次
真题
名校
8 . 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
| A.一定温度下,反应2H2(g)+O2(g) =2H2O(g)能自发进行,该反应的ΔH<0 |
| B.氢氧燃料电池的负极反应为O2+2H2O+4e−=4OH− |
| C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023 |
| D.反应2H2(g)+O2(g) =2H2O(g)的ΔH可通过下式估算:∆H=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和 |
您最近一年使用:0次
2019-06-10更新
|
5085次组卷
|
30卷引用:湖北省荆州中学2020-2021学年高二12月月考化学试题
湖北省荆州中学2020-2021学年高二12月月考化学试题2019年江苏省高考化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编山西省祁县第二中学校2020届高三上学期期中考试化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题陕西省西安中学2020届高三上学期第三次月考化学试题2019年秋高三化学复习强化练习——化学反应的方向及判断(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题(已下线)第六章能力提升检测卷-2021年高考化学一轮复习讲练测江苏省镇江市吕叔湘中学2019-2020学年高二下学期期中考试化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)(已下线)【镇江新东方】高二下21心湖期中安徽省淮北市树人高级中学2020-2021学年高二上学期第四阶段考试化学试题福建省厦门第一中学2020-2021学年高二上学期期中考试化学试题重庆市缙云教育联盟2020-2021学年高二上学期期末考试化学试题辽宁省沈阳市郊联体2021届高三上学期期末考试化学试题黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)【浙江新东方】高中化学20210304-003(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2019年高考江苏卷化学试题变式题(不定项选择题)天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题
名校
9 . 燃煤后烟气脱硫方法之一是利用天然海水的碱性吸收烟气中SO2并转化为无害的SO42-,其流程的示意图如下 (从吸收塔排出的海水中S元素主要以HSO3-形式存在)

下列有关说法正确的是

下列有关说法正确的是
A.海水中碳元素主要以HCO3-的形式存在,HCO3-的水解方程式为HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| B.排入曝气池进行处理时,鼓入大量空气,主要目的是为了将HSO3-氧化为SO42- |
| C.为了加快SO2的吸收速率,进入吸收塔的海水温度越高越好 |
| D.经过曝气池氧化后的“海水”可以直接排放到大海 |
您最近一年使用:0次
名校
10 . 在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。
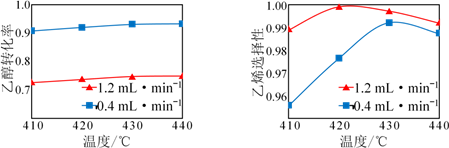
在410~440℃温度范围内,下列说法不正确的是

在410~440℃温度范围内,下列说法不正确的是
| A.温度一定时,随乙醇进料量增大,乙醇转化率减小 |
| B.温度一定时,随乙醇进料量增大,乙烯选择性增大 |
| C.乙醇进料量一定时,随温度的升高,乙烯选择性一定增大 |
| D.选择适当的催化剂在一定条件下,可大幅提高乙烯在最终产物中的比率 |
您最近一年使用:0次
2017-11-29更新
|
347次组卷
|
4卷引用:湖北省新洲一中、黄陂一中、麻城一中2017-2018学年高二上学期期中联考化学试题
湖北省新洲一中、黄陂一中、麻城一中2017-2018学年高二上学期期中联考化学试题2020届高三化学选修4二轮专题练——化学平衡移动的图像分析 【精编25题】江西省抚州市临川第一中学2019-2020学年高二下学期第十一次周测化学试题(已下线)本册综合检测(一)——2020-2021学年高二化学选修四同步单元AB卷(人教版)



